RAPPORT ANNUEL 2009
Le Conseil d'examen du prix des médicaments brevetés a pour mandat de veiller à des prix excessifs ainsi que de faire rapport des tendances des prix de vente de tous les médicaments et des dépenses de R-D des brevetés.
Table des matières
- FAITS SAILLANTS DE 2009
- RÉSUMÉ
- MESSAGE DE LA VICE-PRÉSIDENTE
- LE CONSEIL D’EXAMEN DU PRIX DES MÉDICAMENTS BREVETÉS
- RÉGLEMENTATION DES PRIX DES MÉDICAMENTS BREVETÉS
- ENGAGEMENTS DE CONFORMITÉ VOLONTAIRE ET AUDIENCES
- RÉVISION DES LIGNES DIRECTRICES DU CONSEIL
- RAPPORTS SUR LES PRINCIPALES TENDANCES, 2009
- TENDANCES OBSERVÉES AU NIVEAU DES PRIX
- COMPARAISON DES PRIX PRATIQUÉS AU CANADA AVEC CEUX PRATIQUÉS DANS LES PAYS DE COMPARAISON
- UTILISATION FAITE DES PRODUITS MÉDICAMENTEUX BREVETÉS
- VENTES DE PRODUITS MÉDICAMENTEUX AU CANADA PAR RAPPORT AUX VENTES DANS LES SEPT PAYS DE COMPARAISON
- ANALYSE DES DÉPENSES EN RECHERCHE-DÉVELOPPEMENT
- SYSTÈME NATIONAL D’INFORMATION SUR L’UTILISATION DES MÉDICAMENTS PRESCRITS
- COMMUNICATIONS
- GLOSSAIRE
- ANNEXE 1
- ANNEXE 2
- ANNEXE 3
- ANNEXE 4
FAITS SAILLANTS DE 2009
MANDAT DE RÉGLEMENTATION
Conformité
- 81 nouveaux produits médicamenteux brevetés pour usage humain ont fait l’objet d’un rapport au CEPMB
- les prix de 50 nouveaux produits médicamenteux brevetés ont été jugés conformes aux Lignes directrices
- Au total, 1 177 nouveaux produits médicamenteux brevetés pour usage humain étaient assujettis à la compétence du Conseil.
Application
En 2009 et jusqu’au 31 mai 2010 :
- Le Conseil a approuvé 17 engagements de conformité volontaire, dont trois après l’émission d’un avis d’audience
- Le Conseil a terminé quatre audiences sur le prix (Concerta, Neulasta, Nicoderm, et Quadracel/Pentacel) et émis deux nouveaux avis d’audience (Neulasta, concernant son prix, et Sandoz Canada Inc., concernant le défaut de présenter ses rapports).
- Le Conseil n’a pas encore rendu sa décision dans trois affaires : ratiopharm Inc., pour défaut de présenter ses rapports, ainsi que dans les affaires ratio-Salbutamol HFA et Penlac concernant les prix). Le Conseil a également rendu une ordonnance supplémentaire dans l’affaire de Adderall XR. Quatre audiences ont actuellement cours (Apotex Inc. et Sandoz Canada Inc., pour défaut de présenter leurs rapports, ainsi que Apo-Salvent exempt de CFC et Copaxone (nouvelle examen) concernant le prix).
MANDAT DE RAPPORT
Tendances observées au niveau des ventes
- La valeur des ventes au Canada des produits médicamenteux brevetés a augmenté de 2,8 % en 2009 et totalisé 13,3 milliards de dollars.
- La part des ventes de produits médicamenteux brevetés déclarées par les brevetés par rapport aux ventes de tous les médicaments a encore baissé, passant de 64,7 % qu’elle était en 2008 à 62,4 % en 2009.
- Les principaux produits à l’origine de la croissance des ventes de 2009 par rapport à 2008 sont les agents antinéoplasiques et les agents immunomodulateurs (médicaments utilisés en chimiothérapie).
Tendances observées au niveau des prix des produits médicamenteux brevetés
- Les prix départ-usine des produits médicamenteux brevetés, mesurés à l’aide de l’indice des prix des médicaments brevetés, ont augmenté de 0,3 % par rapport à 2008. L’indice des prix à la consommation a aussi augmenté de 0,3 %.
- Par rapport aux prix pratiqués dans les sept pays de comparaison, les prix au Canada des produits médicamenteux brevetés se situaient en 2009 au troisième rang des prix les plus élevés.
Recherche-développement
- Pour 2009, les brevetés ont fait rapport de dépenses de R-D totalisant 1,2 milliard de dollars, un recul de 2,9 % par rapport à 2008.
- Les brevetés membres de Rx&D ont effectué 89,1 % de toutes les dépenses de R-D déclarées pour 2009.
- Le ratio des dépenses de R-D par rapport aux recettes tirées des ventes a enregistré un faible recul, passant de 8,1 % en 2008 à 7,5 % en 2009. Le ratio des brevetés membres de R&D est passé de 8,9 % en 2008 à 8,2 % en 2009. Le ratio de tous les brevetés se situe sous la barre des 10 % depuis 2001 et celui des membres de Rx&D, depuis 2003.
Le 31 mai 2010
L’honorable Leona Aglukkaq, C.P., députée
Ministre de la Santé
Chambre des communes
Ottawa (Ontario)
K1A 0A6
Madame la ministre,
J’ai le plaisir de vous présenter, conformément aux articles 89 et 100 de la Loi sur les brevets, le Rapport annuel du Conseil d’examen du prix des médicaments brevetés pour l’exercice terminé le 31 décembre 2009.
Croyant le tout conforme, je vous prie d’agréer, Madame la ministre, l’assurance de mes sentiments distingués.
Mary Catherine Lindberg
Vice-présidente
RÉSUMÉ
LE CONSEIL D’EXAMEN DU PRIX DES MÉDICAMENTS BREVETÉS
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) a exercé les deux rôles suivants :
- veillé à ce que les brevetés ne vendent pas leurs médicaments brevetés au Canada à des prix excessifs
- faire rapport des tendances des prix de vente de tous les médicaments ainsi que des dépenses de recherche-développement.
Le CEPMB n’a pas droit de regard sur les prix des médicaments non brevetés, sur les prix auxquels les grossistes et les pharmacies vendent les médicaments ni sur les honoraires des pharmaciens.
GOUVERNANCE
Le Conseil est formé d’au plus cinq membres siégeant à temps partiel, dont un président et un vice-président. Tous les membres du Conseil sont nommés par le gouverneur en conseil. En vertu de la Loi sur les brevets, le président du Conseil assume également les fonctions de chef de la direction et, en cette qualité, est chargé de la gouverne et de la supervision des activités du CEPMB. Selon la Loi, lorsque le poste de président du Conseil est sans titulaire, les pouvoirs et les fonctions du président sont alors dévolus à la personne nommée à la vice-présidence.
BUDGET
Pour l’exercice 2009-2010, le Conseil a disposé d’un budget de 11,9 millions de dollars et d’un effectif approuvé de 76 équivalents temps plein.
RÉGLEMENTATION DES PRIX DES MÉDICAMENTS BREVETÉS
Le CEPMB vérifie les prix auxquels les brevetés vendent aux grossistes, aux hôpitaux, aux pharmacies et autres clients du Canada leurs produits médicamenteux brevetés pour usage humain et pour usage vétérinaire qui sont distribués en vente libre ou sous ordonnance. Il s’assure ainsi que les prix de ces produits ne soient pas excessifs.
Même s’ils ne sont pas tenus de faire approuver les prix de leurs médicaments avant de les vendre sur le marché canadien, la Loi exige que les prix auxquels le brevetés vendent leurs médicaments au Canada ne soient pas excessifs. Les Lignes directrices expliquent le processus que suit le Conseil pour déterminer si un prix est ou non excessif.
TABLEAU 6 Produits médicamenteux brevetés pour usage humain vendus au Canada en 2009 – Statut de l’examen du prix en date du 31 mars 2010
| |
Produits lancés sur le marché en 2009 |
Produits existants |
Total |
| Total |
81 |
1,096 |
1,177 |
| Conformes aux Lignes directrices |
50 |
1,003 |
1,053 |
| Sous examen |
27 |
1 |
28 |
| Sous enquête |
4 |
86 |
90 |
| Avis d’audience |
|
3 |
3 |
| Audiences terminées |
|
3 |
3 |
NOUVEAUX PRODUITS MÉDICAMENTEUX BREVETÉS
En 2009, 81 nouveaux produits médicamenteux pour usage humain ont été lancés sur le marché canadien. Certains de ces médicaments représentent une ou plusieurs concentrations d’une nouvelle substance active et d’autres, de nouvelles présentations de médicaments existants. En date du 31 mars 2009, les prix de 54 des 81 nouveaux DIN brevetés avaient été soumis à un examen. De ce nombre :
- les prix de 50 DIN ont été jugés conformes aux Lignes directrices
- les prix de 4 DIN semblaient plus élevés que ne le permettent les Lignes directrices et une enquête a été engagée
- les prix de 27 DIN sont encore sous examen.
EXAMEN DU PRIX DES PRODUITS MÉDICAMENTEUX BREVETÉS POUR USAGE HUMAIN EXISTANTS
Aux fins du présent rapport, l’expression « produits médicamenteux brevetés existants » désigne tous les produits médicamenteux brevetés vendus sur le marché canadien et ayant fait l’objet d’un rapport au CEPMB avant le 1er décembre 2008. Au moment de la rédaction du présent rapport, 1 096 DIN existants étaient offerts sur le marché canadien. De ce nombre, les prix de 1003 DIN (91,5 %) ont été jugés conformes aux Lignes directrices et les prix de 86 DIN étaient sous enquête.
ENGAGEMENTS DE CONFORMITÉ VOLONTAIRE
En 2009, le Conseil a approuvé dix engagements de conformité volontaire, dont trois après l’émission d’un avis d’audience :
- Andriol, Schering-Plough Canada Inc.
- Brevibloc, Baxter Corporation
- Claritin Allergies + sinus extra fort, Schering-Plough Canada Inc.
- Concerta, Janssen-Ortho Inc.
- Eligard, sanofi-aventis Canada Inc.
- Neulasta, Amgen Canada Inc.
- Strattera, Eli Lilly Inc.
- Suprax, sanofi-aventis Canada Inc.
- Trinipatch, Novartis Pharmaceuticals Canada Inc.
- Vepesid, Bristol-Myers Squibb Canada Inc.
En date du 31 mai 2010, le Conseil a approuvé les sept engagements de conformité volontaire suivants :
- Adenoscan, Astellas Pharma Canada Inc.
- FSME-IMMUN, Baxter Corporation
- Dicetel, Solvay Pharma Inc.
- Levemir Penfill, Novo Nordisk Canada Inc.
- Paxil CR, GlaxoSmithKline Inc.
- Voluven, Fresenius Kabi Canada
- Xarelto, Bayer Inc.
AUDIENCES
En 2009, le Conseil a :
- émis un Avis d’audience concernant le prix du médicament Neulasta
- terminé cinq audiences (Nicoderm; Quandracel et Pentacel), dont trois au moyen d’un engagement de conformité volontaire (Concerta, Neulasta, Strattera)
Pour 2010, en date du 31 mai 2010, le Conseil a :
- émis un avis d’audience à l’encontre de Sandoz Canada Inc. (pour défaut de soumettre ses rapports)
- rendu une ordonnance supplémentaire dans l’affaire du médicament Adderall XR
Les décisions du Conseil sont en instance dans trois affaires : deux concernant les prix (Penlac et ratio-Salbutamol HFA) et une autre concernant le défaut de soumettre ses rapports (ratiopharm Inc.).
Quatre audiences sont en cours : deux concernant les prix (Apo-Salvent exempt de CFC et Copaxone pour un nouvel examen du prix en application d’une ordonnance de la Cour fédérale) et deux pour défaut de présenter les rapports exigés (Apotex Inc. et Sandoz Canada Inc.).
Depuis 1993, outre des réductions de prix, le Conseil a obtenu au moyen des engagements de conformité volontaire et de ses ordonnances des remboursements des recettes excessives totalisant près de 100 millions de dollars. Ces remboursements ont été versés au gouvernement du Canada et (ou) à des clients, nommément des hôpitaux et des cliniques médicales.
RÉVISION DES LIGNES DIRECTRICES SUR LES PRIX EXCESSIFS
Par suite du vaste processus de consultation des intervenants engagé en 2005, les nouvelles lignes directrices sur les prix excessifs sont entrées en vigueur le 1er janvier 2010. La révision des Lignes directrices a permis au Conseil de s’assurer qu’elles étaient encore pertinentes et tout à fait appropriées à l’environnement pharmaceutique actuel.
Au cours des cinq dernières années, le Conseil a reçu plus de cent mémoires en réponse à ses documents de discussion. Il a aussi constitué des groupes de travail conjoints avec l’industrie et d’autres intervenants et tenu des douzaines de rencontres aux quatre coins du pays. En mars 2009, les intervenants ont été invités à exprimer leurs points de vue sur la deuxième ébauche des lignes directrices révisées ainsi que sur la version finale du Compendium des politiques, des lignes directrices et des procédures publiée le 9 juin 2009.
Enfin, au cours de l’été et de l’automne 2009, le personnel du Conseil a tenu des séances d’information afin d’aider les brevetés à bien comprendre les changements apportés aux lignes directrices.
RAPPORT SUR LES PRINCIPALES TENDANCES OBSERVÉES AU NIVEAU DES PRODUITS MÉDICAMENTEUX
TENDANCES AU NIVEAU DES VENTES DES PRODUITS MÉDICAMENTEUX BREVETÉS
La valeur des ventes des produits médicamenteux brevetés a augmenté de 2,8 %, passant de 13,0 milliards de dollars qu’elles étaient en 2008 à 13,3 milliards en 2009.
Toutefois, la croissance des ventes a enregistré une baisse marquée au cours des dernières années. Au cours des années 1990, l’augmentation annuelle de la valeur des ventes était essentiellement attribuable au lancement sur le marché de « médicaments vedettes » qui ont enregistré de très forts volumes de ventes. En 1999, la croissance annuelle de la valeur des ventes était de 27,0 %. Depuis, l’industrie pharmaceutique n’a pas lancé sur le marché suffisamment de « médicaments vedettes » pour maintenir un taux de croissance de la valeur des ventes dans les deux chiffres. Les produits médicamenteux lancés sur le marché entre 1995 et 1999 sont encore à la source de près de 35,9 % des ventes de l’année 2009.
Le pourcentage des ventes de produits médicamenteux brevetés par rapport à l’ensemble des ventes de médicaments a également reculé depuis 2003, ce qui démontre que les ventes de produits médicamenteux génériques et de produits médicamenteux de marque non brevetés ont augmenté davantage que celles des produits médicamenteux brevetés.

TENDANCES OBSERVÉES AU NIVEAU DES PRIX
Le CEPMB utilise l’indice des prix des médicaments brevetés (IPMB) pour faire le suivi des tendances des prix des produits médicamenteux brevetés vendus au Canada. L’IPMB mesure la variation annuelle moyenne des prix départ-usine des produits médicamenteux à l’aide d’une formule utilisant la moyenne pondérée des ventes semblable à celle utilisée pour calculer l’indice des prix à la consommation (IPC). L’IPMB est mis à jour tous les six mois à la lumière de l’information sur les prix et sur les ventes dont les brevetés font rapport au Conseil.
Selon la mesure prise par l’IPMB, les prix des produits médicamenteux brevetés ont augmenté en 2009 d’une moyenne de 0,3 % par rapport à 2008.
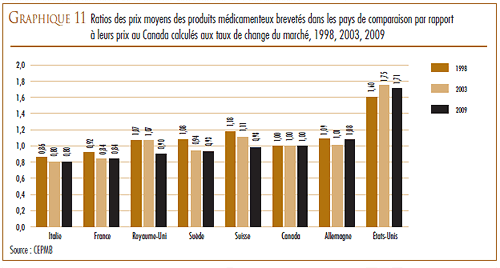
VARIATION DES PRIX DANS LES DIFFÉRENTS PAYS
La Loi et le Règlement sur les médicaments brevetés obligent les brevetés à faire rapport au CEPMB des prix départ-usine divulgués au grand public auxquels ils vendent leurs produits médicamenteux brevetés dans les sept pays de comparaison qui sont la France, l’Allemagne, l’Italie, la Suède, la Suisse, le Royaume-Uni et les États-Unis. Le CEPMB utilise ces données dans ses comparaisons du prix des produits médicamenteux au Canada avec les prix pratiqués dans les pays de comparaison.
D’une façon générale, les prix au Canada des produits médicamenteux brevetés sont moins élevés que la médiane des prix internationaux. En 2009, les prix en Allemagne étaient plus élevés qu’au Canada et ceux des États-Unis l’étaient encore beaucoup plus, mais ils étaient moins élevés dans les cinq autres pays de comparaison.
En 2009, les prix aux États-Unis ont augmenté d’une moyenne de 8 à 9 %. Par contre, les prix en Italie, en Allemagne, en Suède et au Royaume- Uni ont augmenté dans une mesure beaucoup moins grande alors que les prix en France et en Suisse ont légèrement reculé.
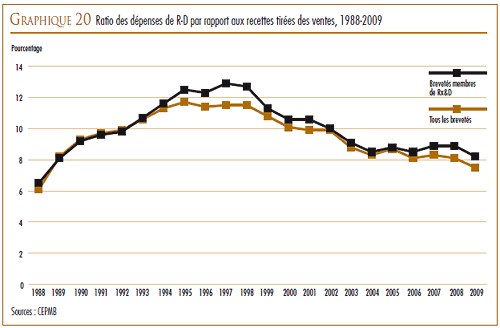
DÉPENSES DE R-D
Les dépenses en R-D pharmaceutique au Canada ont totalisé 1,2 milliard de dollars en 2009, un recul de 2,9 % par rapport à 2008. Pour 2009, les membres de Les Compagnies de recherche pharmaceutique du Canada (Rx&D) ont fait rapport de dépenses en R-D totalisant 1,1 milliard de dollars, ce qui représente une diminution de 3,3 % par rapport à l’année précédente.
En 1987, après la modification de la Loi, Rx&D s’était engagé publiquement à ce que les dépenses annuelles de recherche-développement de ses membres atteignent en 1996 10 % des recettes des ventes. Toutefois, au cours des dernières années, le ratio des dépenses de R-D de tous les brevetés, incluant les membres de Rx&D, a amorcé un mouvement à la baisse. Le ratio des membres de Rx&D est passé de 8,9 % qu’il était en 2008 à 8,2 % en 2009, marquant la septième année consécutive où le ratio était inférieur à 10 %.
Pour 2009, les brevetés ont fait rapport de dépenses de 237,1 millions de dollars dans la recherche fondamentale (une augmentation de 18,4 % par rapport à 2008) et de 685,3 millions dans la recherche appliquée. Les essais cliniques ont accaparé 76,8 % des dépenses de recherche appliquée.
Au regard des sept pays de comparaison, le ratio du Canada des dépenses de R-D par rapport à la valeur des ventes pour 2007 se classait au deuxième rang des ratios les moins élevés, juste après celui de l’Italie. Les ratios de tous les autres pays de comparaison dépassaient de beaucoup celui du Canada.
SYSTÈME NATIONAL D’INFORMATION SUR L’UTILISATION DES MÉDICAMENTS PRESCRITS
Au titre du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP), le CEPMB effectue en partenariat avec les gouvernements fédéral, provinciaux et territoriaux des analyses critiques des prix des médicaments d’ordonnance, de l’utilisation faite de ces médicaments et des tendances observées au niveau de leurs coûts. En 2009, le SNIUMP a travaillé en étroite collaboration avec ses partenaires pour éclairer le processus de prise de décisions au regard des politiques des régimes de santé.
COMMUNICATIONS
Comme il s’est engagé à le faire, le CEPMB ne ménage aucun effort pour faire preuve de transparence et demeurer accessible pour ses intervenants. À cette fin, le CEPMB informe régulièrement ses intervenants sur ses activités par le truchement de ses publications, dont le Rapport annuel et La Nouvelle. Toutes nos publications sont affichées dans notre site Web, y compris les décisions que rend le Conseil après une audience.
MESSAGE DE LA VICE-PRÉSIDENTE
Le CEPMB a passé en 2009 une étape importante de son histoire et en ouvre aujourd’hui un nouveau chapitre.
Permettez-moi, en premier lieu, de souligner la contribution insigne du Dr Brien Benoit dont le mandat à titre de membre, de président et de chef de la direction du CEPMB a pris fin le 18 mai dernier. Le Dr Benoit a joint le Conseil en 2005 alors que de nouveaux problèmes et de nombreux défis se posaient au CEPMB. Le Conseil venait tout juste de publier un document de discussion sur les augmentations des prix des médicaments brevetés et de lancer un processus de révision en profondeur de ses Lignes directrices.
Le Conseil souhaitait ainsi s’assurer que ses Lignes directrices étaient encore pertinentes et bien adaptées au nouvel environnement pharmaceutique. Pour assurer la plus grande participation possible de tous ses intervenants – et plus particulièrement de l’industrie pharmaceutique, des gouvernements fédéral, provinciaux et territoriaux, des associations de consommateurs, des groupes de défense des intérêts des patients, des tiers payeurs – le Conseil a lancé une vaste offensive de consultation. Il a également organisé aux quatre coins du pays des consultations en face-à-face avec des intervenants, des rencontres bilatérales avec les différents groupes d’intervenants et constitué des groupes de travail multilatéraux chargés d’étudier des questions spécifiques. Ce vaste processus a débouché, en juin 2009, sur la publication de nos nouvelles Lignes directrices qui sont entrées en vigueur le 1er janvier 2010.
Le Conseil ne ménage aucun effort pour exercer son mandat avec autant d’ouverture, d’efficacité et d’efficience que possible et ce, à l’enseigne de la bonne gouvernance et de la responsabilisation. À cette fin, il se propose de continuer de solliciter les points de vue de ses intervenants afin que ses décisions soient aussi justes et nuancées que possible et qu’elles servent toujours bien les intérêts de la population canadienne.
Parallèlement à la révision en profondeur de nos Lignes directrices, le Conseil a exercé avec diligence ses activités de réglementation et de rapport et relevé les nouveaux défis qui se posaient en matière de conformité. Plus souvent qu’autrement, le Conseil est saisi d’affaires touchant des questions scientifiques et les prix excessifs des produits médicamenteux de marque brevetés. Les audiences accaparent beaucoup de temps et de ressources du Conseil, mais elles constituent en revanche pour les brevetés une occasion toute choisie de faire entendre leurs points de vue sur des sujets qui leur sont importants. Dans certains cas, les décisions du Conseil font l’objet d’un appel auprès de la Cour fédérale qui, par ses décisions, fournit au Conseil et aux brevetés des éclaircissements sur l’intention de la Loi.
En 2009, le Conseil a poursuivi son partenariat avec l’Institut canadien d’information sur la santé, Santé Canada et les provinces au titre du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP). Il a nommément réajusté ses objectifs, mené des analyses fouillées et formulé des conseils judicieux qui ont permis de remédier aux lacunes au niveau de l’information et de mieux informer les décideurs sur les tendances qui se dessinent au niveau des prix des médicaments et des facteurs influant sur les coûts en médicaments au Canada.
Je saisis également l’occasion pour remercier les employés du Conseil pour leur dévouement, leur enthousiasme et leur soutien continu. Permettez-moi de remercier tout particulièrement notre directrice exécutive, Mme Barbara Ouellet, pour sa contribution des cinq dernières années à l’avancement de notre organisation. Mme Ouellet prendra sous peu une retraite bien méritée. Je tiens aussi à remercier mes collègues membres du Conseil pour leur dévouement et leur travail inlassable.
Le CEPMB est de plus en plus appelé à répondre à de nouvelles exigences découlant de la révision de ses Lignes directrices, à protéger les intérêts de la population canadienne en tenant des audiences publiques sur des questions liées aux prix excessifs et autres activités. Par leur engagement, leur dévouement et leur expertise, les membres du Conseil et les membres du personnel aident chacun à leur façon le CEPMB à bien relever ces défis, à bien servir les intérêts de la population et à assurer la pérennité de notre régime de soins de santé.
Mary Catherine Lindberg
Vice-présidente
LE CONSEIL D’EXAMEN DU PRIX DES MÉDICAMENTS BREVETÉS
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il a été créé par le Parlement en 1987 en vertu de la Loi sur les brevets (la Loi). La Ministre de la Santé est responsable de l’application des dispositions de la Loi formulées aux articles 79 à 103.
Même s’il fait techniquement partie du portefeuille de la Santé, le CEPMB exerce son mandat en toute indépendance de la ministre de la Santé1. Le CEPMB fonctionne également d’une façon indépendante des autres organismes, à savoir Santé Canada qui vérifie l’innocuité et l’efficacité des médicaments et les approuve; les régimes publics fédéral, provinciaux et territoriaux d’assurance-médicaments qui autorisent l’inscription des médicaments sur leurs formulaires de médicaments admissibles à un remboursement et le Programme commun d’examen des médicaments qui, lui, évalue l’efficience des médicaments avant leur inscription sur les formulaires des régimes publics d’assurance-médicaments participants.
COMPÉTENCE
Réglementation
Le CEPMB vérifie les prix auxquels les brevetés vendent leurs produits médicamenteux brevetés pour usage humain ou pour usage vétérinaire distribués sous ordonnance ou en vente libre aux grossistes, aux hôpitaux, aux pharmacies et autres clients canadiens et veille à ce que ces prix ne soient pas excessifs. Le CEPMB réglemente le prix de chaque produit médicamenteux breveté.2
La Cour d’appel fédérale a établi les conditions où, légalement, un brevet est lié à un médicament. De l’avis de la Cour, il doit exister entre le brevet et le produit médicamenteux « un lien si tenu soit-il », ce qui sous-tend une application vaste de la compétence du Conseil. La compétence du Conseil ne s’applique pas exclusivement aux produits médicamenteux dont le brevet porte sur l’ingrédient actif, mais aussi aux médicaments auxquels un brevet est lié, que ce soit au niveau de son procédé de fabrication, de son mode d’administration, de sa forme posologique, de l’indication/utilisation, de la préparation ou autre. Les produits médicamenteux brevetés ne sont pas par définition exclusivement des produits de marque. En effet, certains fabricants de produits génériques sont assujettis à la compétence du Conseil du fait qu’ils vendent en vertu d’une licence d’exploitation le même produit que le produit de marque ou, encore, qu’ils sont titulaires d’un brevet visant le procédé de conditionnement ou de traitement de produits génériques.
Le CEPMB n’est pas habilité à réglementer les prix des médicaments non brevetés. Il n’a aucun droit de regard sur les prix de vente au gros et au détail des médicaments brevetés et non brevetés ni sur les honoraires des pharmaciens. La distribution, l’ordonnance et le remboursement des médicaments échappent aussi à sa compétence.
En vertu de la Loi, les brevetés doivent informer le CEPMB de leur intention de vendre un nouveau produit médicamenteux breveté sur le marché canadien. Après leur première vente, les brevetés doivent faire rapport au CEPMB du prix de vente de leur produit médicamenteux et de la quantité vendue. Par la suite, à la fin de chaque semestre, ils doivent faire rapport des prix et des ventes au Canada des différentes concentrations de leurs produits médicamenteux aux fins de l’examen de leurs prix.
Même s’ils ne sont pas tenus de faire approuver au préalable les prix de vente de leurs produit médicamenteux, les brevetés doivent respecter à la lettre les dispositions de la Loi pour que les prix de vente au Canada de leurs produits ne soient pas considérés excessifs. Lorsque, à l’issue d’une audience publique, il apparaît que le prix d’un produit médicamenteux vendu sur un marché canadien est excessif, le Conseil peut rendre une ordonnance qui oblige le breveté à réduire le prix de son produit médicamenteux et à appliquer les mesures qui lui sont dictées pour rembourser les recettes excessives qu’il a encaissées.
Rapport
Chaque année, le CEPMB doit rendre compte de ses activités au Parlement par le truchement du ministre de la Santé. Le rapport annuel, qui porte sur l’année civile terminée, présente également une analyse des tendances des prix de tous les produit médicamenteux et fait rapport des dépenses de R-D des brevetés au Canada. Par ailleurs, en vertu de l’article 90 de la Loi, le ministre de la Santé peut confier au CEPMB d’autres sujets d’analyse et de rapport.
En 2001, les ministres fédéral, provinciaux et territoriaux de la Santé ont créé le Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP). Plus tard, le ministre de Santé Canada a chargé le CEPMB d’effectuer des recherches et des analyses à l’appui de cette initiative.
En 2005, intervenant aux noms de ses homologues des provinces et des territoires, le ministre de Santé Canada a confié au CEPMB la charge de faire un suivi des prix des produits médicamenteux non brevetés distribués sous ordonnance et de faire rapport de ses observations. Depuis 2008, ces études sont effectuées au titre du SNIUMP.
1 Le portefeuille de la Santé contribue de multiples façons à améliorer l’état de santé de la population canadienne. Il est constitué de Santé Canada, de l’Agence de la santé publique du Canada, des Instituts de recherche en santé du Canada, du Conseil de contrôle des renseignements relatifs aux matières dangereuses, de l’Agence canadienne de contrôle de la procréation assistée et du Conseil d’examen du prix des médicaments brevetés.
2 Dans le présent rapport l’expression « produit médicamenteux breveté » désigne chaque concentration et chaque forme posologique finale de tout médicament. L’expression sous-tend que le produit est assujetti à la compétence du Conseil en matière d’examen du prix.
GOUVERNANCE
Le Conseil est formé d’au plus cinq membres siégeant à temps partiel, dont un président et un vice-président. Tous les membres du Conseil sont nommés par le gouverneur en conseil. En vertu de la Loi sur les brevets, le président du Conseil assume également les fonctions de chef de la direction et, en cette qualité, est chargé de la gouverne et de la supervision des activités du Conseil.
MEMBRES DU CONSEIL
Président
Brien G. Benoit, BA, MD, MSc, FRCSC, FACS
 Brien G. Benoit a été nommé au Conseil du CEPMB en mai 2005. En octobre 2005, il est devenu vice-président du Conseil et a exercé les responsabilités du président du Conseil jusqu’à sa nomination à la présidence en juin 2006. Le mandat du Dr Benoit est arrivé à échéance le 18 mai 2010.
Brien G. Benoit a été nommé au Conseil du CEPMB en mai 2005. En octobre 2005, il est devenu vice-président du Conseil et a exercé les responsabilités du président du Conseil jusqu’à sa nomination à la présidence en juin 2006. Le mandat du Dr Benoit est arrivé à échéance le 18 mai 2010.
Le Dr Benoit, un neurochirurgien, est membre du Corps des médecins titulaires actifs de l’Hôpital d’Ottawa ainsi que professeur de neurochirurgie à l’Université d’Ottawa. À ce titre, il participe sur une base régulière à la formation des médecins faisant leur résidence en neurochirurgie. Le Dr Benoit a occupé au cours de sa carrière différents postes administratifs, dont chef du département de neurochirurgie à l’Hôpital Civic d’Ottawa–Hôpital d’Ottawa (1980 à 2003), chef du département de neurochirurgie de l’Hôpital Civic d’Ottawa (2002 et 2003), médecin-patron du département de neurochirurgie de l’Université d’Ottawa (1995 à 2003), titulaire de la chaire en neurochirurgie à l’Université d’Ottawa (1997 à 2003) et chirurgien-chef adjoint au campus Civic de l’Hôpital d’Ottawa (2002 à 2004).
Le Dr Benoit a publié de nombreux articles dans des revues spécialisées et a participé à plusieurs essais cliniques multicentriques. Il a reçu en 1991 un premier prix d’excellence en enseignement chirurgical du département de chirurgie de l’Université d’Ottawa et un deuxième en 2000.
En plus d’être Fellow du Collège royal des chirurgiens du Canada (neurochirurgie), le Dr Benoit est membre de plusieurs associations professionnelles, dont l’Association médicale canadienne, l’Association médicale de l’Ontario, le American College of Surgeons, la Société canadienne de neurochirurgie et le Congress of Neurological Surgeons.
Vice-présidente
Mary Catherine Lindberg, BSP
 Mary Catherine Lindberg a été nommée membre et vice-présidente du Conseil d’examen du prix des médicaments brevetés en juin 2006. Le 19 mai 2010, Mme Lindberg a assumé les fonctions de la présidence pendant la vacance du poste.
Mary Catherine Lindberg a été nommée membre et vice-présidente du Conseil d’examen du prix des médicaments brevetés en juin 2006. Le 19 mai 2010, Mme Lindberg a assumé les fonctions de la présidence pendant la vacance du poste.
Mme Lindberg a occupé de 2002 à 2009 le poste de directrice exécutive du Ontario Council of Academic Hospitals, un regroupement de 25 hôpitaux universitaires affiliés à une université et à sa faculté de médecine. Avant d’occuper ce poste, Mme Lindberg était sous-ministre adjointe des Services de santé, au ministère de la Santé et des Soins de longue durée de l’Ontario. Elle s’occupait entre autres du Régime d’assurance-maladie de l’Ontario et des Programmes de médicaments.
Mme Lindberg a fait ses études en pharmacie à l’Université de la Saskatchewan et a son permis de pratique en Saskatchewan et en Ontario.
Thomas (Tim) Armstrong, BA, LLB, QC, O. Ont.
 Tim Armstrong a été nommé membre du Conseil en octobre 2002 et a été reconduit dans ses fonctions en 2007.
Tim Armstrong a été nommé membre du Conseil en octobre 2002 et a été reconduit dans ses fonctions en 2007.
M. Armstrong a pratiqué le droit de 1958 à 1974. Il a commencé sa carrière à la division du contentieux des affaires civiles au ministère fédéral de la Justice pour passer ensuite au secteur privé au sein du cabinet Jolliffe, Lewis & Osler et, plus tard, dans le cabinet Armstrong & MacLean spécialisé en droit administratif où il était associé principal. Pendant toutes ces années, il a été appelé à plaider devant différents tribunaux administratifs, différentes cours de la province de l’Ontario, la Cour fédérale et la Cour suprême du Canada.
C’est en 1974 qu’il a choisi de relever de nouveaux défis, cette fois dans la fonction publique de l’Ontario à titre de président du Conseil des relations de travail de l’Ontario (1974-1976), de sous-ministre du Travail (1976-1986), d’agent général de l’Ontario à Tokyo (1986-1990) et de sous-ministre de l’Industrie, du Commerce et de la Technologie (1991-1992). De 1992 à 1995, M. Armstrong a occupé le poste de conseiller du premier ministre de l’Ontario en matière de développement économique.
De 1995 à 2002, il a travaillé comme avocat-conseil au sein du cabinet d’avocats McCarthy Tétrault. Au cours des années 1990, M. Armstrong a siégé au conseil d’administration d’Algoma Steel, de deHavilland Aircraft et de Interlink Freight.
Depuis 1996, M. Armstrong est le représentant principal du Canada à la Japan Bank for International Cooperation. Il est également médiateur-arbitre en relations de travail. En 1998 et 1999, M. Armstrong a occupé le poste de facilitateur-médiateur à la Commission de restructuration des services de santé de l’Ontario. En 2002-2003, il a servi comme médiateur-arbitre pour le gouvernement de l’Ontario en vertu de la City of Toronto Labour Disputes Resolution Act, 2002.
M. Armstrong est président de l’Institut de radioprotection du Canada. Son rapport sur les métiers et l’apprentissage a servi à l’élaboration de la Loi sur la qualification professionnelle et l’apprentissage des gens de métier, 2009, de l’Ontario.
M. Armstrong a été reçu membre de l’Ordre de l’Ontario en 1995 en reconnaissance de sa contribution insigne à la fonction publique de l’Ontario.
Anthony Boardman, BA, PhD
 Anthony Boardmana été nommé au Conseil en janvier 1999. Son mandat, renouvelé en mars 2005, a pris fin le 10 mars 2010.
Anthony Boardmana été nommé au Conseil en janvier 1999. Son mandat, renouvelé en mars 2005, a pris fin le 10 mars 2010.
M. Boardman est professeur Van Dusen d’administration des affaires à la Sauder School of Business de l’Université de la Colombie-Britannique, plus particulièrement au sein de la Division de l’économie des entreprises. Il est diplômé de l’Université Kent de Canterbury (BA, 1970) ainsi que de l’Université Carnegie-Mellon (PhD, 1975). Avant de devenir professeur à l’Université de la Colombie-Britannique, M. Boardman a enseigné à la Wharton School de l’Université de la Pennsylvanie.
M. Boardman mène actuellement des recherches sur les partenariats public-privé, sur les analyses coûts-avantages et sur la gestion stratégique. Il a enseigné la gestion dans différents pays, dont la Finlande, la Chine et l’Australie, et a reçu au cours de sa carrière différents prix soulignant l’excellence de ses activités en enseignement dont le prix Alan-Blizzard.
M. Boardman a travaillé comme expert-conseil pour différents organismes privés et publics, dont Vodafone, Stora Enzo, PricewaterhouseCoopers et le ministère du Trésor de la Nouvelle-Zélande, ainsi que pour différents gouvernements du Canada. Entre 1995 et 2001, M. Boardman a siégé au Comité scientifique sur l’initiative de pharmacoéconomie de la Colombie-Britannique. Il a été président de la direction de Strategy and Business Economics de l’Université de la Colombie-Britannique au cours de deux mandats. Il siège actuellement aux conseils éditoriaux du Journal of Comparative Policy Analysis et de Strategic Outsourcing: An International Journal.
Au cours de sa carrière, M. Boardman a signé de nombreux articles savants. Il a récemment reçu le prix J.E.-Hodgetts pour le meilleur article publié dans le Canadian Public Administration in 2008 (en partenariat avec A.R. Vining). Il vient de mettre la touche finale à la quatrième édition de son livre Cost-Benefit Analysis: Concepts and Practice. Il a également co-édité le International Handbook on Public-Private Partnerships qui devrait aller sous presse quelque temps en 2010.
Anne Warner La Forest, LLB (UNB), LLM (Cantab)
 Anne Warner La Forest siège au Conseil depuis mars 2007.
Anne Warner La Forest siège au Conseil depuis mars 2007.
Mme La Forest est professeure de droit à l’Université du Nouveau-Brunswick. Membre depuis 2004 de la Commission des valeurs mobilières du Nouveau-Brunswick, elle a présidé jusqu’en juin 2008 le Comité sur les ressources humaines. Elle a été nommée membre principale de la Commission en juillet 2008.
En 1991, après avoir pratiqué le droit pendant plusieurs années dans le cabinet Fraser & Beatty de Toronto, Mme La Forest a joint la faculté de droit de l’Université Dalhousie. De 1996 à 2004, elle a occupé le poste de doyenne de la faculté de droit à l’Université du Nouveau-Brunswick. Membre des barreaux du Nouveau-Brunswick, de la Nouvelle-Écosse et de l’Ontario, Mme La Forest a une très vaste expérience en arbitrage et a agi à titre de consultante dans des affaires relatives au droit de la personne, à l’emploi, à la propriété et à l’extradition. Elle a été membre du Tribunal des droits de la personne de la NouvelleÉcosse ainsi que membre du Conseil de recherche en sciences sociales et en sciences humaines et présidente du Comité d’attribution des bourses de recherche. Mme La Forest a aussi œuvré comme arbitre dans la province de la Nouvelle-Écosse ainsi que comme commissaire à la Commission des droits de la personne de la Nouvelle-Écosse. Elle est Fellow de la Cambridge Commonwealth Society et membre du Conseil des gouverneurs de l’Institut national de la magistrature.
Mme La Forest détient un baccalauréat spécialisé en droit international de l’Université de Cambridge, au Royaume-Uni.
Au cours de sa carrière, Mme La Forest a publié des articles, des livres ainsi que des arrêts remarqués. Elle a aussi participé à de nombreuses conférences de droit nationales et internationales, parfois à titre de présidente et d’autres fois à titre de panéliste.
HAUTE DIRECTION DU CEPMB
La haute direction du CEPMB est constituée de la directrice exécutive, de la directrice – Affaires réglementaires et liaison auprès des brevetés, du directeur – Politiques et analyse économique, de la directrice – Services généraux, de la directrice – Secrétariat du Conseil et Communications et de l’avocate générale.
Directrice exécutive
La directrice exécutive assure la gouverne générale des activités du CEPMB et avise le Conseil. Elle supervise le travail des employés du Conseil et en assume le leadership.
Affaires réglementaires et liaison auprès des brevetés
La direction Affaires réglementaires et liaison auprès des brevetés fait l’examen des prix des produits médicamenteux brevetés vendus au Canada pour s’assurer qu’ils ne sont pas excessifs. De plus, elle encourage les brevetés à se conformer volontairement aux Lignes directrices du Conseil, veille à la bonne application des politiques de conformité et fait enquête sur les plaintes reçues concernant les prix de certains produits médicamenteux brevetés. De plus, la Direction sensibilise les brevetés sur les Lignes directrices du Conseil et les informe de leurs obligations en matière de présentation de rapports.
Politiques et analyse économique
La direction Politiques et analyse économique formule lorsqu’il y a lieu des conseils stratégiques concernant les changements qui pourraient être apportés aux Lignes directrices et à d’autres politiques du Conseil. Elle effectue des recherches ainsi que des analyses des tendances des prix des produits médicamenteux et en présente les résultats dans des rapports. Enfin, elle effectue les études à l’appui des activités de conformité et d’application et les études que lui commande le ministre de la Santé.
Services généraux
La direction des Services généraux offre conseils et services en matière de gestion des ressources humaines, des installations, de la santé et sécurité au travail, de la technologie et de la gestion de l’information. Elle s’occupe également de la planification stratégique et de la planification financière, des vérifications, de l’évaluation et de la liaison auprès des agences centrales fédérales compétentes.
Secrétariat du Conseil et Communications
Le Secrétariat du Conseil planifie et orchestre les communications du CEPMB, les relations avec les médias et le suivi aux demandes de renseignements du grand public. Il gère les réunions et les audiences du Conseil, dont les dossiers de procédure. Il coordonne les activités du Conseil relatives à l’application de la Loi sur l’accès à l’information et de la Loi sur la protection de la vie privée.
Avocate générale
L’avocate générale fournit des opinions juridiques au CEPMB et dirige l’équipe de la poursuite dans les audiences du Conseil.
BUDGET
Pour l’exercice 2009-2010, le Conseil a disposé d’un budget de 11,9 millions de dollars et d’un effectif approuvé de 76 équivalents temps plein.
TABLEAU 1 Budget et effectif
| |
2008–2009 |
2009–2010 |
2010–2011 |
| Budget total du CEPMB |
11 122 M$ |
11 971 M$ |
12 181 M$ |
| Équivalents temps plein |
71 |
76 |
76 |
RÉGLEMENTATION DES PRIX DES MÉDICAMENTS BREVETÉS
Le personnel du Conseil passe régulièrement en revue les données fournies sur les prix de tous les produits médicamenteux brevetés offerts sur le marché canadien afin de s’assurer qu’ils sont conformes aux Lignes directrices du Conseil. Les Lignes directrices appliquent les facteurs de détermination du prix mentionnés dans l’article 85 de la Loi sur les brevets. Elles ont été formulées par le Conseil en consultation avec ses intervenants, dont les ministres de la Santé des provinces et des territoires, les associations de consommateurs et l’industrie pharmaceutique. Dans la présente section, les références aux Lignes directrices renvoient à la version en vigueur avant le 1er janvier 2010.
EXIGENCES EN MATIÈRE DE RAPPORT
La Loi sur les brevets (la Loi) et le Règlement sur les médicaments brevetés (le Règlement) dictent les rapports que doivent soumettre les brevetés ou les anciens brevetés d’une invention liée à un médicament breveté assujetti à la compétence du CEPMB.
L’information sur ces exigences est présentée dans la Loi, dans le Règlement, dans les Lignes directrices et dans le Guide du breveté. Tous ces documents sont affichés dans notre site Web.
Dans l’exercice du volet réglementation de son mandat, le CEPMB compte sur la ponctualité des brevetés en ce qui a trait à la présentation de leurs rapports sur tous les produits médicamenteux brevetés qu’ils vendent au Canada.
Défaut de présenter ses rapports
La présentation en retard des rapports sur un produit médicamenteux auquel un brevet est lié pose un problème de taille en ce sens qu’elle retarde indûment l’examen du prix. En 2009, 23 nouveaux produits médicamenteux brevetés qui étaient vendus au Canada avant 2009 ont fait l’objet d’un premier rapport au CEPMB.
Le tableau qui suit présente les produits médicamenteux qui étaient brevetés et vendus au Canada qui ont fait l’objet d’un rapport tardif au Conseil.
Défaut de présenter les données sur les prix et sur les ventes (Formulaire 2)
En 2009, le Conseil n’a pas eu à émettre d’ordonnances aux fins d’obtenir les rapports exigés pour les périodes de rapport 2009.
TABLEAU 2 Défaut de présenter ses rapports
| Breveté |
Nom de marque |
Nom générique |
Année où le médicament est devenu assujetti à la compétence du Conseil |
| Biovail Pharmaceuticals Canada |
Raliva
100 mg/comprimé,
200 mg/comprimé,
300 mg/comprimé, |
chlorhydrate de tramadol |
2007 |
| Boehringer Ingelheim (Canada) Ltée |
Mirapex
0.125 mg/comprimé |
dichlorhydrate de pramipexole
|
2008 |
| Hospira Healthcare Corporation (Canada) |
Paclitaxel
6 mg/ml |
paclitaxel |
2008 |
Pamidronate Disodium
30 mg/fiole,
60 mg/fiole,
90 mg/fiole |
pamidronate
disodium |
2003 |
Precedex
100 mcg/ml |
chlorhydrate de dexmédétomidine |
2008 |
| Genzyme Canada Inc. |
Clolar
20 mg/fiole |
clofarabine |
2005 |
| Paladin Labs Inc. |
Tridural
100 mg/comprimé,
200 mg/comprimé,
300 mg/comprimé |
chlorhydrate de tramadol
|
2007 |
| Ranbaxy Pharmaceuticals Canada Inc. |
Ran-Pantoprozole
20 mg/comprimé,
40 mg/comprimé |
pantoprozole
sodium |
2008 |
Ran-Rabeprazole
10 mg/comprimé,
20 mg/comprimé |
rabeprazole
sodium |
2007 |
Ran-Rispéridone
0.25 mg/comprimé,
0.5 mg/comprimé,
1 mg/comprimé,
2 mg/comprimé,
3 mg/comprimé,
4 mg/comprimé |
rispéridone |
2006 |
Groupe consultatif sur les médicaments pour usage humain
Le Conseil a créé le Groupe consultatif sur les médicaments pour usage humain (GCMUH) pour recevoir ses recommandations concernant le classement des nouveaux produits médicamenteux ainsi que concernant la sélection des produits médicamenteux qui se prêtent à la comparaison selon la catégorie thérapeutique avec le produit sous examen.
Le GCMUH effectue l’évaluation scientifique des produits médicamenteux brevetés et formule des conseils scientifiques crédibles, indépendants et éclairés quant à l’élaboration et l’application des Lignes directrices du CEPMB relatives à l’examen scientifique. L’approche du Groupe se fonde sur l’expérience clinique et ses recommandations reflètent les connaissances médicales et scientifiques ainsi que la pratique clinique.
En 2009, le GCMUH était constitué de trois membres :
- Dr Jean Gray, professeure émérite en enseignement médical, médecine et pharmacologie à l’Université Dalhousie
- Dr Mitchell Levine, professeur, Département de l’épidémiologie clinique et de la biostatistique à l’Université McMaster et directeur du Centre d’évaluation des médicaments de St. Joseph’s Healthcare, à Hamilton
- Dr Adil Virani, directeur des services pharmaceutiques à la Fraser Health Authority et chargé de cours à la faculté des sciences pharmaceutiques de l’Université de la Colombie-Britannique
En janvier 2010, dans la foulée de l’entrée en vigueur des nouvelles Lignes directrices, trois autres membres ont joint le GCMUH :
- Dr Fred Y. Aoki, professeur de médecine, de microbiologie médicale et de pharmacologie et thérapeutique à l’Université du Manitoba
- Dr Jacques LeLorier, professeur aux départements de médecine et de pharmacologie de l’Université de Montréal et professeur auxiliaire au département d’épidémiologie et de biostatistique de l’Université McGill
- M. Muhammad Mamdani, directeur du Centre de recherche appliquée en santé, du Li Ka Shing Knowledge Institute de l’hôpital St. Michael’s de Toronto ainsi que professeur agrégé au Département des politiques de santé, gestion et évaluation de l’Université de Toronto
Nouveaux produits médicamenteux brevetés lancés sur le marché canadien en 2009
Au total, 81 nouveaux produits médicamenteux brevetés (aussi appelés DIN) pour usage humain ont été lancés sur le marché canadien qui on fait objet d’un rapport en 2009. Certains de ces produits médicamenteux représentent une ou plusieurs concentrations d’une nouvelle substance active et d’autres, de nouvelles présentations de produits médicamenteux existants.
Aux fins de l’examen du prix, tout produit médicamenteux breveté lancé ou vendu sur le marché canadien avant l’attribution de son premier brevet entre le 1er décembre 2008 et le 30 novembre 2009 est réputé avoir été breveté en 2009.
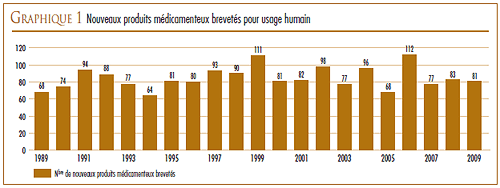
Le graphique 1 présente le nombre de nouveaux médicaments brevetés pour usage humain lancés sur le marché canadien entre 1989 et 2009.
Seize (20 %) des 81 nouveaux DIN brevetés ont été commercialisés au Canada avant d’avoir obtenu un premier brevet canadien qui les aurait automatiquement assujettis à la compétence du CEPMB. Ces DIN sont identifiés par les lettres « PBA » (pour « premier brevet accordé ») dans l’annexe 2, à la page 46 du présent rapport. Le tableau 3 présente le nombre de produits médicamenteux brevetés selon l’année de leur première vente sur le marché canadien. Pour ces produits, le délai écoulé entre la date de la première vente et celle de l’obtention d’un premier brevet varie entre plusieurs mois et plusieurs années. Un de ces produits (le Miochol-E, un médicament de Novartis Pharma Canada Inc. utilisé après une chirurgie pour les cataractes) était vendu sur le marché canadien avant 1987, année de la création du CEPMB.
La liste des nouveaux produits médicamenteux brevetés ayant fait l’objet d’un rapport au CEPMB est mise à jour chaque trimestre et affichée dans notre site Web. Cette liste présente de l’information sur le statut de l’examen (par ex. sous examen, conforme aux Lignes directrices, sous enquête, engagement de conformité volontaire, avis d’audience).
TABLEAU 3 Nouveaux produits médicamenteux brevetés pour usage humain ayant fait l’objet d’un rapport au CEPMB en 2009 selon l’année de leur première vente
| Année de la première vente |
Nbre de DIN |
| 2009 |
68 |
| 2008 |
3 |
| 2007 |
7 |
| 2006 |
0 |
| 2005 |
0 |
| 2004 |
1 |
| 2003 |
1 |
| 1960 |
1 |
| Total |
81 |
Nouvelles substances actives assujetties à la compétence du CEPMB en 2009
Une nouvelle substance active (NSA) peut être associée à plusieurs DIN lorsqu’elle est distribuée sous plusieurs concentrations ou sous plusieurs formes posologiques. Les 22 NSA lancées sur le marché canadien en 2009 ont été commercialisées sous 30 DIN. Comme on peut le voir dans le graphique 2 et dans le tableau 4, 6 des 22 NSA brevetées assujetties à la compétence du CEPMB en 2009 étaient offertes sur le marché canadien avant 2009.
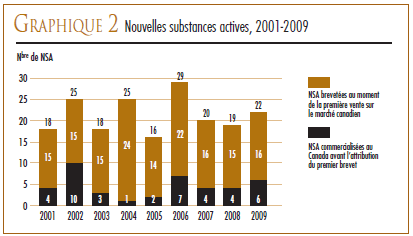
Lorsque l’examen du prix d’une nouvelle substance active est terminé et que son prix a été jugé conforme aux Lignes directrices, le CEPMB affiche dans son site Web le rapport sommaire de son examen. Le graphique 3 ventile pour la période 2001 à 2009 les NSA pour usage humain brevetées selon la catégorie dans laquelle elles ont été classées aux fins de l’examen du prix.
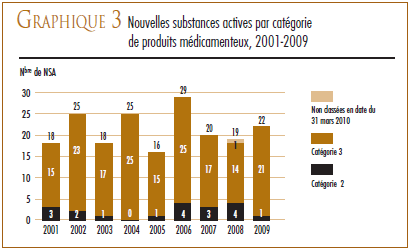
TABLEAU 4 Nouvelles substances actives, 2009
| Nom de marque |
Nom chimique |
Breveté |
Nbre de DIN |
Utilisation thérapeutique |
| Alrex |
étabonate de loteprednol |
Bausch & Lomb Canada Inc. |
1 |
Conjonctivite allergique |
| Cimzia |
certolizumab pegol |
UCB Canada Inc. |
1 |
Polyarthrite rhumatoïde |
| Doribax |
doripénem |
Janssen-Ortho Inc. |
1 |
Antibiotique |
| Emend IV |
fosaprépitant diméglumine |
Merck Frosst Canada Ltd. |
1 |
Prévention des nausées consécutives à l’administration d’une chimiothérapie anticancéreuse |
| Firmagon |
dégarélix |
Ferring Inc. |
2 |
Cancer de la prostate |
| Lotemax |
étabonate de loteprednol de méthyle |
Bausch & Lomb Canada Inc. |
1 |
Inflammation oculaire après une opération de la cataracte |
| Metvix |
chlorhydrate d’aminolévulinate de méthyle |
Galderma Canada Inc. |
1 |
Agent antinéoplasique |
| Multaq |
chlorhydrate de dronédarone |
sanofi-aventis Canada Inc. |
1 |
Agent antiarythmique |
| Olmetec |
olmésartan médoxomil |
Schering-Plough Canada Inc. |
2 |
Agent antihypertenseur |
| Olmetec Plus |
olmésartan médoxomil hydrochlorothiazide |
Schering-Plough Canada Inc. |
3 |
Agent antihypertenseur |
| Pristiq |
succinate de desvenlafaxine |
Wyeth Pharmaceuticals |
2 |
Antidépresseur |
| Stelara |
ustekinumab |
Janssen-Ortho Inc. |
1 |
Psoriasis |
| Synflorix |
vaccin antipneumococcique conjugué |
GlaxoSmithKline Inc. |
1 |
Vaccin |
| Tykerb |
ditosylate de lapatinib |
GlaxoSmithKline Inc. |
1 |
Cancer du sein |
| Xeomin |
neurotoxine de Clostridium Botulinum de type A |
Merz Pharma Canada Ltd. |
1 |
Myorelaxant |
| Zolinza |
varinostat |
Merck Frosst Canada Ltd. |
1 |
Agent antinéoplasique |
Nouvelles substances actives vendues au Canada avant 2009
| Nom de marque |
Nom chimique |
Breveté |
Nbre de DIN |
Utilisation thérapeutique |
| Abilify |
aripiprazole |
Bristol-Myers Squibb Canada Co. |
1 |
Schizophrénie |
| Apidra Solostar |
insulin glulisine |
sanofi-aventis Canada Inc. |
1 |
Diabète |
| Somatuline Autogel |
lanreotide acetate |
Tercica Inc. |
2 |
Acromégalie |
| Sprycel |
dasatinib |
Bristol-Myers Squibb Canada Co. |
3 |
Leucémie |
| Tasigna |
nilotinib |
Novartis Pharma Canada Inc. |
1 |
Leucémie |
| Zeftera |
ceftobiprole medocaril |
Janssen-Ortho Inc. |
1 |
Antibactérien |
EXAMEN DU PRIX DES NOUVEAUX PRODUITS MÉDICAMENTEUX BREVETÉS POUR USAGE HUMAIN EN 2009
La liste des 81 nouveaux produits médicamenteux brevetés, incluant le statut de l’examen de leur prix au moment de la rédaction du présent rapport, est présentée dans l’Annexe 2, à la page 46. Des 81 nouveaux DIN brevetés :
- 54 avaient été soumis à un examen du prix en date du 31 mars 2010. De ce nombre :
- les prix de 50 DIN ont été jugés conformes aux Lignes directrices
- les prix de 4 DIN semblaient plus élevés que ne l’autorisent les Lignes directrices et ont justifié une enquête. De plus amples explications sur les critères qui justifient la tenue d’une enquête sont présentées à l’Annexe 1, à la page 45.
- enfin, les prix des 27 autres DIN étaient encore sous examen.
Suivi : nouveaux produits médicamenteux brevetés dont il a été fait mention dans des rapports annuels antérieurs
Le tableau 5 présente une mise à jour du statut des nouveaux produits médicamenteux brevetés (DIN) dont il a été fait mention dans des rapports annuels antérieurs.
TABLEAU 5 Statut des nouveaux produits médicamenteux brevetés ayant fait l’objet d’un rapport au CEPMB, 2003-2008
| |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
| Nouveaux produits médicamenteux (DIN) mentionnés dans un rapport annuel |
70 |
94 |
66 |
99 |
64 |
78 |
| Défaut de présenter un rapport après la publication du rapport annuel |
7 |
2 |
2 |
13 |
13 |
5 |
| Nbre de DIN pour l’annéer |
77 |
96 |
68 |
112 |
77 |
83 |
| Sous examen |
0 |
0 |
0 |
0 |
1* |
0 |
| Conformes aux Lignes directrices |
72 |
78 |
60 |
100 |
71 |
77 |
| Sous enquête |
0 |
0 |
0 |
2 |
2 |
5 |
Engagement de conformité
volontaire |
1 (Dukoral) |
2 (Paxil CR)
1 (Hextend)
2 (Eloxatin)
1 (Forteo) |
1 (Nuvaring)
1 (Vaniqa)
|
1 (Denavir)
1 (Lantus)
1 (Andriol)
3 (Trinipatch)
1 (Levemir) |
2 (Androgel)
1 (Voluven) |
1 (Xarelto) |
| Avis d’audience |
– |
1 (Penlac)
1 (Copaxone) |
– |
– |
– |
– |
| Avis d’audience/Engagement de conformité volontaire |
1 (Evra)
3 (Concerta) |
3 (Risperdal Consta)
1 (Neulasta) |
5 (Strattera)
1 (Concerta |
– |
– |
– |
| Audience close |
– |
6 (Adderall XR) |
– |
– |
– |
– |
* Suite à un défaut de présenter ses rapports
Examen des prix des produits médicamenteux brevetés existants pour usage humain, 2009
Aux fins du présent rapport, les produits médicamenteux brevetés existants (DIN) désignent tous les produits médicamenteux brevetés vendus sur le marché canadien avant le 1er décembre 2008 et ayant fait l’objet d’un rapport au CEPMB. Au moment de la rédaction du présent rapport, 1 096 DIN existants étaient offerts sur le marché canadien :
- les prix de 1 003 DIN existants (91,5 %) ont été jugés conformes aux Lignes directrices
- les prix de 86 DIN existants faisaient l’objet d’une enquête
- de ce nombre, 12 enquêtes sont attribuables au prix de lancement du produit médicamenteux :
- 5 en 2006
- 2 en 2007
- 5 en 2008
- 19 autres DIN sont actuellement sous enquête. Trois de ces DIN n’étaient plus vendus au pays en 2009 et les brevets de 16 de ces DIN étaient arrivés à échéance.
- 1 DIN existant était encore sous examen
- 4 DIN – Apo-Salvent exempt de CFC, Copaxone, Penlac et ratio-Salbutamol HFA font l’objet d’une audience sur le prix en vertu de l’article 83 de la Loi (voir la section « Audiences », à la page 15)
- en 2009, le médicament Penlac n’était plus assujetti à la compétence du Conseil du fait que son brevet est arrivé à échéance en 2009
- 6 DIN – Neulasta, Nicoderm (3 DIN), Quadracel et Pentacel faisaient l’objet d’une audience sur le prix, mais ces audiences ont été closes suite à un engagement de conformité volontaire ou à une ordonnance du Conseil (voir la section « Audiences », à la page 15)
- en 2009, le médicament Nicoderm n’était plus assujetti à la compétence du Conseil
Le tableau 6 donne un aperçu du statut d’examen en 2009 des produits médicamenteux brevetés pour usage humain nouveaux et existants.
TABLEAU 6 Produits médicamenteux brevetés pour usage humain vendus au Canada en 2009 – Statut de l’examen du prix en date du 31 mars 2010
| |
Produits lancés sur le marché en 2009 |
Produits existants |
Total |
| Total |
81 |
1 096 |
1 177 |
| Conformes aux Lignes directrices |
50 |
1 003 |
1 053 |
| Sous examen |
27 |
1 |
28 |
| Sous enquête |
4 |
86 |
90 |
| Avis d’audience |
|
3 |
3 |
| Audiences terminées |
|
3 |
3 |
Mise à jour : Rapport annuel 2008
- Les examens de 17 des 18 produits médicamenteux pour usage humain et des 8 produits médicamenteux pour usage vétérinaire qui étaient sous examen en date de la publication du rapport annuel 2008 ont été finalisés en 2009
- 67 des 125 enquêtes mentionnées dans le rapport annuel 2008 se sont soldées par les résultats suivants :
- la fermeture de l’enquête lorsque le prix s’est révélé conforme aux Lignes directrices
- un engagement de conformité volontaire par lequel le breveté s’engage à réduire le prix de son médicament et à rembourser les recettes excessives qu’il a encaissées au moyen d’un paiement et (ou) de la réduction du prix d’un autre de ses produits médicamenteux brevetés (pour plus de renseignements sur les engagements de conformité volontaire approuvés en 2009, voir la rubrique « Engagements de conformité volontaire » à la page 12), et
- une audience publique dont l’objet est de déterminer si le prix du produit médicamenteux est ou non excessif, incluant une ordonnance corrective rendue par le Conseil (pour plus de renseignements sur les audiences que le Conseil a tenues en 2009, voir la rubrique « Audiences» à la page 15).
Produits médicamenteux brevetés en vente libre et produits médicamenteux brevetés pour usage vétérinaire
Le personnel du Conseil ne fait l’examen des prix des produits médicamenteux brevetés en vente libre et des produits médicamenteux brevetés pour usage vétérinaire que suite à la réception d’une plainte. Le Conseil n’a reçu en 2009 aucune plainte concernant les prix de ces deux types de produits médicamenteux brevetés.
Le Programme commun d’évaluation des médicaments et le CEPMB
Le Programme commun d’évaluation des médicaments (PCEM), un processus uniformisé d’évaluation des nouveaux produits médicamenteux, fournit aux régimes d’assurance-médicaments fédéral, provinciaux et territoriaux participants des recommandations concernant l’ajout de certains produits médicamenteux à leurs formulaires respectifs de produits admissibles à un remboursement. De toutes les provinces et de tous les territoires, seul le Québec ne participe pas à ce programme. Le PCEM fait l’examen des nouveaux produits médicamenteux et recommande ceux qui devraient être admissibles à un remboursement par les régimes publics d’assurance-médicaments. Au moment de prendre des décisions concernant l’inscription de produits médicamenteux sur les formulaires de produits admissibles à un remboursement, les différents régimes publics d’assurance-médicaments évaluent la recommandation du Comité consultatif canadien d’expertise sur les médicaments (CCCEM) dans le contexte de leur mandat, de leurs priorités et de leur budget. De plus amples renseignements sur le PCEM et sur le CCCEM sont présentés dans le site Web de l’Agence canadienne des médicaments et des technologies de la santé (ACMTS) (http://www.cadth.ca).
Le tableau 7 présente les produits médicamenteux soumis en 2009 à l’examen du Programme commun d’évaluation des médicaments ainsi que leur statut au regard des Lignes directrices du CEPMB. Les produits médicamenteux sont soumis à l’examen du Programme commun d’évaluation des médicaments après l’émission d’un Avis de conformité par Santé Canada. Les produits médicamenteux vendus au Canada alors qu’ils ne sont pas brevetés ou avant l’obtention du brevet ne sont pas assujettis à la compétence du Conseil en matière d’examen du prix.
TABLEAU 7 Recommandations du Programme commun d’évaluation des médicaments et statut des différents médicaments suite à l’examen du prix par le CEPMB
| Recommandation du CCCEM en 2009 |
|
|
Statut du médicament en vertu du CEPMB |
Utilisation thérapeutique |
| Alendronate monosodique/cholécalciférol |
Fosavance
70/5600
|
Recommandation positive** |
Conforme aux Lignes directrices |
Ostéoporose |
| Neurotoxine de Clostridium Botulinum de type A |
Xeomin |
Recommandation positive** |
Sous examen |
Myorelaxant |
| Dabigatran-extexilate |
Pradax |
Recommandation négative |
Conforme aux Lignes directrices |
Prévention de la thrombo-embolie veineuse |
| succinate de desvenlafaxine |
Pristiq |
Recommandation négative |
Conforme aux Lignes directrices |
Antidépresseur |
| éplérénone |
Inspra |
Recommandation négative |
Non assujetti à la compétence du CEPMB |
Traitement de l’insuffisance cardiaque après un récent infarctus du myocarde |
| insuline glulisine |
Apidra |
Recommandation positive** |
Sous examen |
Diabète |
| lévodopa/carbidopa |
Duodopa |
Recommandation négative |
Méd. breveté, aucune vente déclarée |
Maladie de Parkinson |
| dimésylate de lisdexamfétamine |
Vyvanse |
Recommandation négative |
Non assujetti à la compétence du CEPMB |
Trouble déficitaire de l’attention |
| Bromure de méthylnaltrexone |
Relistor |
Recommandation négative |
Conforme aux Lignes directrices |
Constipation causée par les médicaments opioïdes |
| olmésartan médoxomil |
Olmetec |
Recommandation positive** |
Conforme aux Lignes directrices |
Antihypertenseur |
| olmésartan médoxomil hydrochlorothiazide |
Olmetec Plus |
Recommandation positive** |
Conforme aux Lignes directrices |
Antihypertenseur |
| ustekinumab |
Stelara |
Recommandation positive* |
Conforme aux Lignes directrices |
Psoriasis |
* Sous réserve de critères/conditions
** Inscrire au même titre que d’autres produits médicamenteux de la même catégorie
Sources : CEPMB et ACMTS
ENGAGEMENTS DE CONFORMITÉ VOLONTAIRE ET AUDIENCES
Le personnel du Conseil fait l’examen des prix de tous les produits médicamenteux brevetés offerts sur le marché canadien. Lorsque le prix d’un produit semble plus élevé que ne l’autorisent les Lignes directrices et que les circonstances justifient une enquête, le personnel du Conseil mène une enquête aux fins de déterminer si le prix du produit est ou non conforme aux Lignes directrices. Vous trouverez de plus amples explications sur les critères qui justifient une enquête dans l’Annexe 1, page 45. L’enquête peut mener à l’un ou l’autre des résultats suivants :
- la fermeture de l’enquête lorsqu’il apparaît que le prix est conforme aux Lignes directrices
- un engagement de conformité volontaire par lequel le breveté s’engage à réduire le prix de son produit et à rembourser les recettes excessives qu’il a encaissées au moyen d’un paiement et (ou) d’une réduction du prix d’un autre de ses produits médicamenteux brevetés, ou
- une audience publique aux fins de déterminer si le prix du produit est ou non excessif et, le cas échéant, l’imposition d’une ordonnance correctrice.
ENGAGEMENTS DE CONFORMITÉ VOLONTAIRE
L’engagement de conformité volontaire est un engagement écrit par lequel le breveté s’engage à rendre le prix de son produit médicamenteux conforme aux Lignes directrices, ce qui comprend le rajustement du prix de son produit à un niveau non excessif et le remboursement des recettes excessives qu’il a encaissées. Les brevetés peuvent soumettre un engagement de conformité volontaire même si une enquête a déterminé que le prix au Canada de leur produit médicamenteux breveté semble être plus élevé que ne le permettent les Lignes directrices. Ils peuvent également soumettre un engagement de conformité volontaire après l’émission d’un avis d’audience, mais à ce point l’engagement doit être approuvé par le panel d’audience.
En 2009, le Conseil a approuvé 10 engagements de conformité volontaire, dont trois après l’émission d’un avis d’audience :
- Andriol, Schering-Plough Canada Inc.
- Brevibloc, Baxter Corporation
- Claritin allergies + sinus extra fort, Schering-Plough Canada Inc.
- Concerta, Janssen-Ortho Inc. (avis d’audience)
- Eligard, sanofi-aventis Canada Inc.
- Neulasta, Amgen Canada Inc. (avis d’audience)
- Strattera, Eli Lilly Canada Inc. (avis d’audience)
- Suprax, sanofi-aventis Canada Inc.
- Trinipatch, Novartis Pharmaceuticals Canada Inc.
- Vepesid, Bristol-Myers Squibb Canada Inc.
Andriol, Schering-Plough Canada Inc.
Le 16 octobre 2009, le président du Conseil a approuvé l’engagement de conformité volontaire que lui a soumis Schering-Plough Canada Inc. pour son produit médicamenteux breveté Andriol 40 mg/gélule. En vertu de cet engagement, Schering-Plough a remis au gouvernement du Canada 348 605,86 $ pour rembourser les recettes excessives encaissées et a consenti à tous ses clients une réduction de 21,25 % du prix maximal jugé non excessif (MNE) de 2009 de son produit.
Le produit médicamenteux Andriol (testostérone undecanoate) est indiqué comme thérapie de remplacement chez les hommes souffrant de problèmes de santé associés à des symptômes de déficience ou d’absence de testostérone endogène : pour la gestion de l’hypogonadisme primaire congénital ou acquis et de l’hypogonadisme hypogonadotropique, pour développer et conserver les caractéristiques sexuelles secondaires chez les hommes ayant une déficience en testostérone, stimuler la puberté clairement tardive de garçons soigneusement sélectionnés dont le retard n’est pas secondaire à un trouble pathologique. Andriol est utilisé comme thérapie de remplacement dans les cas d’impuissance ou pour traiter les symptômes climatères des hommes lorsque les problèmes de santé sont causés par une déficience androgène mesurée ou documentée.
Brevibloc, Baxter Corporation
Le 5 octobre 2009, le président du Conseil a approuvé l’engagement de conformité volontaire que lui a soumis Baxter Corporation pour son produit médicamenteux breveté Brevibloc. En vertu de cet engagement, Baxter a remboursé à ses clients qui ont acheté son produit les recettes excessives qu’il a tirées de ses ventes à un prix excessif et qui totalisaient 212 440,76 $.
Le produit médicamenteux Brevibloc (chlorhydrate d’esmolol) est indiqué pour la gestion périopératoire de la tachycardie et de l’hypertension chez les patients pour lesquels on craint un déficit d’oxygène du myocarde et qui, de l’avis de leur médecin, sont clairement à risque d’ischémie myocardique d’origine hémodynamique, et pour le contrôle rapide de la fréquence ventriculaire des patients ayant une fibrillation auriculaire ou un flutter auriculaire dans des situations graves lorsque l’utilisation d’un agent à action rapide est souhaitable.
Claritin allergies + sinus extra fort, Schering-Plough Canada Inc.
Le 2 décembre 2009, le président du Conseil a approuvé l’engagement de conformité volontaire que lui a soumis Schering-Plough pour son produit médicamenteux breveté Claritin allergies + sinus extra fort. En vertu de cet engagement, Schering-Plough a remis 69 950,43 $ au gouvernement du Canada pour rembourser les recettes excessives qu’il a tirées de la vente de son produit à un prix excessif.
Le produit médicamenteux Claritin allergies + sinus extra fort (loratadine à 10 mg et sulfate de pseudoéphédrine à 240 mg) est indiqué pour le soulagement des symptômes associés à une rhinite allergique, y compris la congestion du nez et des sinus, les éternuements, l’écoulement nasal et le larmoiement et l’énanthème conjonctival.
Concerta, Janssen-Ortho Inc.
Le 24 avril 2009, le Panel d’audience a approuvé l’engagement de conformité volontaire que lui ont conjointement soumis les parties de l’audience et ainsi clos l’audience engagée suite à un avis d’audience émis le 24 juillet 2006. En vertu de cet engagement, Janssen-Ortho Inc. a remis 1 464 441,58 $ au gouvernement du Canada pour rembourser les recettes excessives tirées de la vente de son produit à un prix excessif.
CLe produit médicamenteux Concerta est indiqué pour le traitement des troubles déficitaires de l’attention avec hyperactivité.
Eligard, sanofi-aventis Canada Inc.
Le 20 avril 2009, le président du Conseil a approuvé l’engagement de conformité volontaire que lui a soumis sanofi-aventis pour son produit médicamenteux breveté Eligard. En vertu de cet engagement, sanofiaventis Canada a, dans la majorité des provinces, réduit les prix de son produit Eligard aux prix MNE de 2009 ayant cours en date du 31 décembre 2009 et remis 13 127 953,14 $ au gouvernement du Canada pour rembourser les recettes excessives tirées entre janvier 2005 et décembre 2008 de la vente de son produit à des prix excessifs. Les recettes excessives encaissées au cours de l’année 2009 ont été remboursées directement aux hôpitaux, aux cliniques de cancer et aux conseils du cancer qui ont acheté le produit.
Le produit médicamenteux breveté Eligard (suspension injectable d’acétate de leuprolide) est indiqué pour le traitement palliatif du cancer de la prostate ayant atteint un stade avancé.
Neulasta, Amgen Canada Inc.
Le 21 octobre 2009, le Panel d’audience a approuvé l’engagement de conformité volontaire que lui ont soumis les parties et ainsi clos les procédures engagées le 16 mars 2009 avec l’émission d’un avis d’audience. En vertu de son engagement de conformité volontaire, Amgen a réduit le prix de son produit médicamenteux Neulasta au prix MNE fixé pour 2009 et remis 6 730 120,32 $ au gouvernement du Canada pour rembourser les recettes excessives qu’il a tirées de la vente de son produit à des prix supérieurs aux prix MNE entre la date de lancement de son produit sur le marché canadien et le 30 juin 2009. Amgen a remis un deuxième paiement de 687 724,53 $ au gouvernement du Canada pour rembourser les recettes excessives encaissées entre le 1er juillet et le 31 décembre 2009.
Le produit médicamenteux Neulasta (pegfilgrastim) est indiqué pour réduire l’incidence de l’infection, telle qu’elle se manifeste par une neutropénie fébrile chez les patients ayant des tumeurs malignes non myéloïdes ou cancéreuses auxquels on administre des médicaments myélosuppresseurs antinéoplasiques.
Strattera, Eli Lilly Canada Inc.
Le 19 février 2009, le Panel d’audience a approuvé l’engagement de conformité volontaire soumis pour le produit médicamenteux Strattera et ainsi clos le processus d’audience engagé le 15 décembre 2006 avec l’émission d’un avis d’audience. En vertu de cet engagement, Eli Lilly a remis au gouvernement du Canada les recettes excessives qu’il a encaissées au moyen de deux paiements, le premier au montant de15 326 066,49 $ et le deuxième, de 108 157,85 $.
Le produit médicamenteux Strattera est indiqué pour le traitement des enfants de 6 ans et plus, des adolescents et des adultes atteints du trouble déficitaire de l’attention avec hyperactivité.
Suprax, sanofi-aventis Canada Inc.
Le 9 mars 2009, le président du Conseil a approuvé l’engagement de conformité volontaire soumis par sanofi-aventis pour son produit médicamenteux breveté Suprax 400 mg/comprimé. En vertu de cet engagement, sanofi-aventis a réduit le prix de son produit Suprax à un niveau se situant dans les limites de son prix MNE établi pour l’année 2009 et remis au gouvernement du Canada les recettes excessives qu’il a encaissées au moyen de deux paiements, l’un de 97 900,30 $ et l’autre de 31 532,93 $.
Le produit médicamenteux Suprax 400 mg/comprimé (céfixime) est un antibiotique utilisé pour traiter les infections causées par des souches sensibles de microorganismes désignés.
Trinipatch, Novartis Pharmaceuticals Canada Inc.
Le 18 novembre 2009, le président du Conseil a approuvé l’engagement de conformité volontaire soumis par Novartis pour son produit médicamenteux Trinipatch. En vertu de son engagement, Novartis a remis 47 099,61 $ au gouvernement du Canada pour rembourser les recettes excessives qu’il a encaissées de la vente de son produit à un prix excessif.
Le produit médicamenteux TrinipatchMD (nitroglycérine) est un médicament breveté qui a été vendu sur le marché canadien entre le 16 mars 2006 et le 13 janvier 2009. Le TrinipatchMD est indiqué dans la prévention des crises angineuses chez les patients ayant une angine de poitrine stable associée à une coronaropathie.
Vepesid, Bristol-Myers Squibb Canada Co.
Le 23 février 2009, le président du Conseil a approuvé l’engagement de conformité volontaire soumis par Bristol-Myers Squibb pour son produit médicamenteux Vepesid. En vertu de cet engagement, Bristol-Myers Squibb a remboursé la somme de 53 161,48 $ à ses clients qui avaient acheté son produit à des prix excessifs.
Le produit médicamenteux Vepesid (étoposide) est utilisé avec d’autres agents antinéoplasiques pour traiter en première ligne certaines maladies néoplasiques.
En date du 31 mai 2010, le Conseil a approuvé les sept engagements de conformité volontaire suivants :
- Adenoscan, Astellas Pharma Canada Inc.
- Dicetel, Solvay Pharma Inc.
- FSME-IMMUN, Baxter Corporation
- Levemir Penfill, Novo Nordisk Canada Inc.
- Paxil CR, GlaxoSmithKline Inc.
- Voluven, Fresenius Kabi Canada
- Xarelto, Bayer Inc.
Adenoscan, Astellas Pharma Inc.
Le 8 mai 2010, le président du Conseil a approuvé l’engagement de conformité volontaire soumis par Astellas Pharma Inc. pour son médicament Adenoscan. En vertu de cet engagement, Astellas Pharma a remis au gouvernement du Canada la somme de 34 545,32 $ représentant le montant des recettes excessives encaissées entre 1996 et le 4 août 2009 (date d’échéance du brevet).
Adenoscan (adénosine en solution injectable) est utilisé avec le thallium- 201 dans la scintigraphie de perfusion myocardique lorsque l’épreuve d’effort est impossible à effectuer ou inappropriée.
Dicetel, Solvay Pharma Inc.
Le 13 mai 2010, le président du Conseil a approuvé l’engagement de conformité volontaire soumis par Solvay Pharma Inc. pour son médicament Dicetel. En vertu de cet engagement, Solvay Pharma Inc. a remis au gouvernement du Canada la somme de 31 287,32 $ représentant le montant des recettes excessives encaissées entre le 1er janvier 2008 et le 31 décembre 2009. De plus, pour les recettes excessives encaissées entre le 1er janvier 2010 et la date de l’acceptation du présent engagement de conformité volontaire, Solvay Pharma remettra d’ici au 30 août 2010 un autre paiement au gouvernement du Canada au montant calculé par le personnel du Conseil.
Le Dicetel est indiqué pour le traitement et le soulagement de la douleur associée au syndrome du colon irritable, à la douleur abdominale, aux troubles du transit et à l’inconfort intestinal lié aux troubles fonctionnels intestinaux. Il est également indiqué pour le traitement symptomatique des douleurs liées aux troubles fonctionnels des voies biliaires.
FSME-IMMUN, Baxter Corporation
Le 31 mars 2010, le président du Conseil a approuvé l’engagement de conformité volontaire soumis par Baxter Corporation pour son produit médicamenteux breveté FSME-IMMUN. En vertu de cet engagement, Baxter a réduit le prix de son produit et remis 53 578,62 $ au gouvernement du Canada pour rembourser les recettes excessives encaissées entre le 1er janvier 2002 et le 31 décembre 2009.
Le produit médicamenteux FSME-IMMUN (vaccin inactivé contre l'encéphalite à tiques) est indiqué pour les personnes de 16 ans et plus susceptibles de contracter le virus de l'encéphalite à tiques transmis par certaines tiques.
Levemir Penfill, Novo Nordisk Canada Inc.
Le 8 mai 2010, le président du Conseil a approuvé l’engagement de conformité volontaire soumis par Novo Nordisk Canada Inc. pour son médicament Levemir. En vertu de cet engagement, Novo Nordisk Canada doit d’ici au 14 juin 2010 remettre au gouvernement du Canada la somme de 6 035 903,54 $ représentant le montant des recettes excessives encaissées entre le 3 janvier 2006 et le 31 décembre 2009. De plus, pour les recettes excessives tirées entre le 1er janvier et le 31 mars 2010, Novo Nordisk Canada remettra au gouvernement du Canada les recettes excessives encaissées au cours de cette période dont le montant sera calculé par le personnel du Conseil à la lumière des données que le breveté a soumises dans son rapport sur les prix et sur les ventes couvrant cette période.
Levemir Penfill est indiqué pour le traitement d’adultes atteints de diabète sucré type 1 ou 2 qui ont besoin d’insuline à action prolongée (de base) pour le maintien d’un contrôle glycémique.
Paxil CR, GlaxoSmithKline Inc.
Le 31 mars 2010, le président du Conseil a approuvé l’engagement de conformité volontaire soumis par GlaxoSmithKline Inc. pour son produit médicamenteux breveté Paxil CR. En vertu de cet engagement, GlaxoSmithKline a remis 53 177,88 $ au gouvernement du Canada pour rembourser les recettes excessives encaissées entre janvier 2004 et décembre 2005.
Le produit médicamenteux Paxil CR (chlorhydrate de paroxétine) est un inhibiteur sélectif de recaptage de la sérotonine. Ce produit, qui est présenté sous une nouvelle forme posologique – à savoir un comprimé à libération contrôlée, est indiqué pour le traitement symptomatique de la dépression et du trouble panique.
Voluven, Fresenius Kabi Canada
Le 10 janvier 2010, le président du Conseil a approuvé l’engagement de conformité volontaire soumis par Fresenius Kabi Canada pour son produit médicamenteux Voluven. En vertu de son engagement, Fresenius a remis 1 448 002,25 $ au gouvernement du Canada pour rembourser les recettes excessives tirées de la vente de son produit à un prix excessif. Son brevet étant arrivé à échéance le 7 août 2008, le médicament Voluven n’était plus assujetti à la compétence du CEPMB.
Le produit médicamenteux Voluven (hydroxyéthylamidon) est indiqué pour traiter l’hypovolémie, lorsqu’une expansion du volume plasmatique est nécessaire.
Xarelto, Bayer Inc.
En vertu de l’engagement de conformité volontaire que le président du Conseil a approuvé le 11 janvier 2010, Bayer a réduit le prix de son produit médicamenteux Xarelto et remis au gouvernement du Canada les recettes excessives encaissées et ce, au moyen de deux paiements, l’un de 49 978,33 $ et l’autre de 193 292,96 $.
Le produit médicamenteux Xarelto (rivaroxaban) est indiqué dans la prévention des maladies thromboemboliques veineuses chez les patients qui ont subi une arthroplastie totale non urgente de la hanche ou une arthroplastie totale du genou.
Les brevetés sont tenus de veiller à ce que les prix de leurs produits médicamenteux brevetés soient conformes aux Lignes directrices au cours des différentes périodes où ils sont assujettis à la compétence du Conseil.
AUDIENCES
Lorsque le prix d’un médicament breveté semble excessif, le Conseil peut tenir une audience publique et, s’il est démontré que le prix du produit médicamenteux est excessif, rendre une ordonnance obligeant le breveté à réduire le prix de son produit et à rembourser la partie excessive des recettes qu’il a tirées de la vente de son produit à un prix excessif. Les brevetés peuvent interjeter appel des décisions du Conseil auprès de la Cour fédérale du Canada.
En 2009, le Conseil a :
- émis un avis d’audience concernant le prix du médicament breveté Neulasta, et
- finalisé cinq audiences dans les affaires suivantes : Concerta, Neulasta, Nicoderm, Quandracel-Pentacel et Strattera.
Pour 2010, en date du 31 mai 2010, le Conseil a :
- émis un avis d’audience à l’encontre de Sandoz Canada Inc. pour défaut de soumettre ses rapports, et
- rendu une ordonnance supplémentaire dans l’affaire du produit médicamenteux breveté Adderall XR.
Les décisions sont en instance dans trois affaires, dont deux sur le prix (Penlac et ratio-Salbutamol HFA), et une pour défaut de soumettre ses rapports (ratiopharm Inc.)
Quatre audiences ont actuellement cours, dont deux sur le prix Apo-Salvent exempt de CFC et Copaxone pour nouvel examen (suite à l’ordonnance de la Cour fédérale) pour plus amples renseignements, voir la rubrique « Appels interjetés auprès de la Cour fédérale », ci-après), et deux autres pour défaut de soumettre leurs rapports – Apotex Inc. et Sandoz Canada Inc.
Depuis 1993, le Conseil a approuvé 66 engagements de conformité volontaire et entamé 24 audiences. Ces mesures ont donné lieu à des réductions de prix et au remboursement des recettes excessives au moyen de paiements au gouvernement du Canada et (ou) aux clients, dont les hôpitaux et les cliniques médicales.
La valeur cumulative des remboursements des recettes excessives au moyen de paiements au gouvernement dépassait plus de 37 millions de dollars en 2009. En date de la rédaction du présent rapport, la valeur des recettes excessives remboursées en 2010 était environ de six millions de dollars.
Vous trouverez dans l’Annexe 3, page 49, de plus amples détails sur les recettes excessives remboursées au gouvernement en vertu des engagements de conformité volontaire et des ordonnances du Conseil.
APPELS INTERJETÉS AUPRÈS DE LA COUR FÉDÉRALE
Au cours de l’année 2009, certaines décisions du Conseil ont fait l’objet de révision judiciaire par la Cour fédérale.
Copaxone, Teva Neuroscience G.P.-S.E.N.C.
Le 8 mai 2006, le Conseil a émis un Avis d’audience dans l’affaire du médicament Copaxone.
Le 28 février 2008, le Panel d’audience a rendu sa décision et ses motifs et, le 12 mai 2008, son ordonnance. Teva Neuroscience a déposé auprès de la Cour fédérale une requête en révision judiciaire de la décision du Conseil. Dans la décision qu’elle a rendue le 12 novembre 2009, la Cour fédérale a infirmé les décisions du Conseil et enjoint le Conseil de constituer un nouveau panel pour entendre l’affaire à nouveau.
Nicoderm, sanofi-aventis Canada Inc.
sanofi-aventis a déposé une requête en révision judiciaire de la décision du Conseil de poursuivre l’audience sur le fond. Le 24 septembre 2009, la Cour fédérale a rejeté la requête de sanofi-aventis.
Pentacel and Quadracel, sanofi pasteur Limitée
Le 27 mars 2007, le Conseil a émis un Avis d’audience dans cette affaire. Le 21 décembre 2009, le Panel d’audience a rendu sa décision et ses motifs et, le 15 mars 2010, son ordonnance. sanofi pasteur a déposé auprès de la Cour fédérale une requête en révision judiciaire de la décision du Conseil. Au moment d’aller sous presse, la Cour fédérale n’avait pas encore fixé la date de son audience.
Communiqué du Conseil aux intervenants daté du 18 août 2008
Suite à la publication du communiqué du 18 août 2008 portant sur l’obligation des brevetés de faire rapport au Conseil des avantages consentis aux différentes catégories de clients, Rx&D et al. et Pfizer Canada Inc. ont déposé des requêtes en révision judiciaire du Communiqué du Conseil. Dans sa décision rendue le 10 juillet 2009, la Cour fédérale a affirmé : « que l’alinéa 4(1)f)(i) et le paragraphe 4(4) du Règlement sur les médicaments brevetés n’autorisent pas le Conseil à exiger qu’on lui fournisse des renseignements relatifs aux rabais ou remboursements à des tierces parties par des fabricants de médicaments brevetés ». Les partis dans cette affaire n’ont pas interjeté appel de la décision.
AFFAIRE DEVANT LA COUR SUPRÊME DU CANADA
Thalomid, Celgene Corporation
Le Panel d’audience a entendu les parties concernant la compétence du Conseil dans l’affaire du produit médicamenteux Thalomid administré à des patients canadiens en vertu du Programme d’accès spécial de Santé Canada. Dans la décision qu’il a rendue le 21 janvier 2008, le Conseil a confirmé sa compétence sur le prix du produit médicamenteux Thalomid. Celgene Corporation a déposé auprès de la Cour fédérale une requête en révision judiciaire, laquelle requête a été entendue le 3 mars 2009. Dans sa décision du 17 mars 2009, la Cour fédérale a infirmé la décision du Conseil. Le Procureur général du Canada a interjeté appel de la décision de la Cour fédérale auprès de la Cour d’appel fédérale. Dans sa décision du 21 décembre 2009, la Cour d’appel fédérale a confirmé la décision du Conseil. Le 22 avril 2010, la Cour suprême du Canada a donné à Celgene Corporation l’autorisation d’interjeter appel de la décision de la Cour d’appel fédérale auprès de la Cour suprême du Canada. Au moment d’aller sous presse, la Cour suprême du Canada n’avait pas encore fixé la date de l’audience.
TABLEAU 8 Statut des audiences devant le Conseil
| Produit médicamenteux breveté |
Indication/Utilisation |
Breveté |
Date de l’avis d’audience |
Statut |
| Adderall XR |
Traitement des troubles déficitaires de l’attention avec hyperactivité (TDAH) |
Shire Canada Inc. |
18 janvier 2006 |
Ordonnance supplémentaire : 5 mai 2010 |
| Apo-Salvent exempt de CFC |
Soulagement du malaise respiratoire causé par des spasmes et par le rétrécissement du diamètre des bronches. |
Apotex Inc |
8 juillet 2008 |
En cours |
| Concerta |
Traitement des troubles déficitaires de l’attention avec hyperactivité (TDAH) |
Janssen-Ortho Inc. |
24 juillet 2006 |
Engagement de conformité volontaire : 24 avril 2009 (voir page 13) |
| Copaxone – nouvel examen |
Réduction de la fréquence des rechutes chez les malades en traitement ambulatoire atteints de la sclérose en plaques à périodes progressives et rémittentes |
Teva Neuroscience G.P.-S.E.N.C. |
8 mai 2006 |
Décision de la Cour fédérale : 12 nov. 2009 ordonnance d’un nouvel examen Audience : 4-5 oct. 2010 |
| Nicoderm |
Atténuation des symptômes d’assuétude du tabac |
sanofi-aventis Canada Inc. |
20 avril 1999 |
Décision du Conseil : 9 avril 2010 |
| Penlac |
Traitement complémentaire des ongles des patients immunocompétents atteints d’une onychomycose ou infection fongique des ongles ne touchant pas la lunule |
sanofi-aventis Canada Inc. |
27 mars 2007 |
Décision en instance |
| Pentacel |
Immunisation systématique des enfants de 2 à 59 mois contre la diphtérie, le tétanos, la coqueluche, la poliomyélite et l’haemophilus influenzae de type b. Le médicament est offert au Canada sous forme de fiole monodose de Act-HIB (poudre lyophilisée pour injection) et d’une ampoule à dose unique (0,5 ml) de Quadracel (suspension pour injection). |
sanofi pasteur Limitée |
27 mars 2007 |
Décision du Conseil : 21 déc. 2009 (modifée le 1er mars 2010) Ordonnance du Conseil : 16 mars 2010Requête en révision judiciaire – 19 janv. 2010 |
| Quadracel |
Primovaccination des nourrissons de 2 mois et plus et vaccin de rappel pour les enfants jusqu’à 7 ans contre la diphtérie, le tétanos, la coqueluche et la poliomyélite |
sanofi pasteur Limitée |
27 mars 2007 |
Décision du Conseil : 21 déc. 2009 (modifiée le 1er mars 2010) Ordonnance du Conseil : 16 mars 2010 Requête en révision judiciaire – 19 janv. 2010 |
| ratio-Salbutamol HFA |
Soulagement du malaise respiratoire causé par des spasmes et par le rétrécissement du diamètre des bronches |
ratiopharm Inc. |
18 juillet 2008 |
Décision en instance |
| Strattera |
Traitement des enfants de 6 ans et plus, des adolescents et des adultes atteints du trouble déficitaire de l’attention avec hyperactivité (TDAH) |
Eli Lilly Canada Inc. |
15 déc. 2006 |
Engagement de conformité volontaire :19 février 2009 (voir page 13) |
| Breveté |
Indication/Utilisation |
Date de l’avis d’audience |
Statut |
| Apotex Inc. |
|
3 mars 2008 |
En cours |
| ratiopharm Inc. |
|
28 août 2008 |
Décision du Conseil en instance |
| Sandoz Canada Inc. |
|
8 mars 2010 |
Audience en cours : 6-8 déc. 2010 |
RÉVISION DES LIGNES DIRECTRICES DU CONSEIL
C’est le 1er janvier 2010 qu’est entré en vigueur le nouveau Compendium des politiques, des Lignes directrices et des procédures du Conseil. L’article 96(4) de la Loi sur les brevets prévoit que le Conseil peut formuler des directives sur toutes questions relevant de sa compétence sans que le Conseil ou les brevetés ne soient liées par celles-ci dans le contexte d’une audience. Les Lignes directrices expliquent aux brevetés et aux membres du personnel du Conseil comment vérifier si les prix au Canada de produits médicamenteux brevetés sont ou non excessifs et, par la suite, comment les maintenir à des niveaux non excessifs. Elles présentent également les procédures qui sont normalement appliquées lorsque le prix d’un produit médicamenteux breveté semble excessif.
La publication des nouvelles Lignes directrices du Conseil a marqué la fin du processus de révision des Lignes directrices qui s’est échelonné sur presque cinq années et qui a été ponctué par des consultations auprès des intervenants intéressés, nommément l’industrie (médicaments de marque, biotechnologie et médicaments génériques), les gouvernements fédéral, provinciaux et territoriaux, les associations de consommateurs, les groupes de défense des intérêts des consommateurs, les tiers payeurs et autres.
CONSULTATIONS AUPRÈS DES INTERVENANTS
En mars 2005, le Conseil a publié le Document de discussion sur les augmentations des prix des médicaments brevetés. Par leurs commentaires, les intervenants ont fait comprendre au Conseil qu’il devait pousser plus loin ses analyses et tenir d’autres consultations sur différents sujets, dont l’adoption de nouvelles catégories d’amélioration des bienfaits thérapeutiques pour mieux tenir compte des petites améliorations apportées aux produits médicamenteux, du rôle du prix de lancement comme facteur d’augmentation des coûts en médicaments et des variations de prix sur les marchés au Canada. Par ailleurs, en raison de la nature évolutive de l’environnement pharmaceutique et du fait que les Lignes directrices n’avaient pas vraiment été révisées depuis 1994, le Conseil est arrivé à la conclusion qu’une révision plus en profondeur de ses Lignes directrices était nécessaire pour s’assurer qu’elles étaient encore pertinentes et appropriées.
En mai 2006, le CEPMB a officiellement engagé la révision de ses Lignes directrices avec la publication de son document Guide de discussion aux fins des consultations sur les Lignes directrices du Conseil sur les prix excessifs. En novembre 2006, après avoir reçu 44 mémoires, le Conseil a tenu à Edmonton, Montréal, Toronto, Halifax et Ottawa une série de consultations en face-à-face auxquelles ont participé 145 intervenants.
En mai 2007, le Conseil a publié un Communiqué à l’intention de ses intervenants dans lequel il faisait le point sur ses décisions préliminaires ainsi que sur les orientations qu’il entendait prendre concernant les questions soumises à la consultation. Ce communiqué a été suivi, en septembre 2007, par une série de réunions bilatérales auxquelles ont participé 73 intervenants de l’industrie des médicaments, des gouvernements F-P-T et des associations de consommateurs. En janvier 2008, le Conseil a publié le document de discussion intitulé Changements qui pourraient être apportés au Règlement sur les médicaments brevetés, 1994 et aux Lignes directrices sur les prix excessifs. Ce document traitait essentiellement des questions soumises à la consultation en cours ainsi que des questions soulevées par la Cour fédérale du Canada en ce qui concerne l’interprétation de son Règlement.
Au début 2008, le Conseil a constitué cinq groupes de travail représentant les différents intervenants afin qu’ils discutent ensemble de différentes questions touchant les Lignes directrices, dont la réglementation des produits médicamenteux génériques brevetés, les niveaux d’amélioration des bienfaits thérapeutiques, la comparaison du prix au Canada selon la catégorie thérapeutique internationale, les coûts associés à la « fabrication » et à la « mise en marché » dans l’examen du prix et les tests auxquels le CEPMB soumet les prix. Les rapports de ces groupes de travail ont été publiés au cours du printemps et de l’été 2008.
Avec en toile de fond les consultations antérieures et les recommandations des groupes de travail, le Conseil a publié le 20 août 2008 un premier Avis et commentaires – Ébauche des Lignes directrices révisées. Le personnel du Conseil a tenu sept séances d’information à l’intention de ses intervenants, à savoir l’industrie pharmaceutique (médicaments de marque, biotechnologie, médicaments génériques), les associations de consommateurs, les représentants des gouvernements F-P-T et les tiers payeurs.
L’Avis et commentaires d’août 2008 a suscité 42 mémoires ainsi que des rencontres avec des représentants de Rx&D, de BIOTECanada, de l’Association canadienne du médicament générique (ACMG) et du Programme des médicaments de l’Ontario au cours desquelles le Conseil a pu discuter directement avec eux de leurs préoccupations. Le Conseil a aussi organisé d’autres séances de discussion avec le conseil d’administration de Rx&D.
En mars 2009, les intervenants ont été invités à communiquer à nouveau au Conseil leurs commentaires au moyen d’un deuxième Avis et commentaires – Ébauche des Lignes directrices révisées. Pour ce deuxième Avis et commentaires, le Conseil a reçu 31 mémoires. Le personnel du Conseil a organisé six séances d’information à l’intention toute particulière de l’industrie pharmaceutique (médicaments de marque, biotechnologie, médicaments génériques), d’associations de consommateurs, de gouvernements F-P-T et de tiers payeurs.
PUBLICATION DES LIGNES DIRECTRICES RÉVISÉES
La vaste consultation a éclairé les décisions du Conseil au moment où il travaillait à la version finale de son Compendium des politiques, des Lignes directricies et des procédures qu’il a publiée le 9 juin 2009. Le Conseil a publié en même temps que le nouveau Compendium le document intitulé Résultats de la consultation de mars 2009 et les Lignes directrices révisées du Conseil sur les prix excessifs dans lequel le Conseil a présenté sa position concernant les derniers changements apportés ainsi que leur justification.
Dans la foulée de la publication des nouvelles Lignes directrices, le personnel du Conseil a tenu des séances d’information à Toronto et à Montréal pour aider les brevetés à mieux saisir la portée des changements et ainsi les préparer à se conformer aux nouvelles Lignes directrices.
PRINCIPAUX CHANGEMENTS APPORTÉS AUX LIGNES DIRECTRICES
Par rapport à l’ancienne version des Lignes directrices du Conseil, la version révisée est rédigée dans un style plus clair avec une terminologie plus uniforme. Sa structure est aussi mieux harmonisée aux processus d’examen et d’enquête du personnel du Conseil. On y trouve également de nouvelles sections qui décrivent entre autres le cadre juridique du Conseil et ses politiques et qui présentent d’une façon plus détaillée la façon dont elles seront appliquées. Pour votre gouverne, voici quelques-uns des principaux changements apportés :
Niveaux d’amélioration des bienfaits thérapeutiques – Le processus d’examen scientifique des nouveaux produits médicamenteux brevetés se fonde désormais sur quatre niveaux d’amélioration des bienfaits thérapeutiques (découverte, amélioration importante, amélioration minime, amélioration modeste ou nulle) plutôt que trois (découverte/amélioration importante, amélioration modeste/minime/nulle, extension d’une gamme de produits). De nouveaux facteurs secondaires ont été ajoutés au processus d’examen scientifique afin de permettre le classement d’un produit du niveau « amélioration modeste/nulle » au niveau « amélioration minime ». Par ces ajouts, le Conseil souhaite se donner le moyen de tenir davantage compte des « petites améliorations » qui, par rapport aux médicaments « vedettes », semblent constituer la nouvelle tendance du secteur des nouveaux produits médicamenteux.
Harmonisation des tests appliqués aux prix – Les tests qui étaient auparavant appliqués aux prix selon la catégorie thépareutique à laquelle le produit médicamenteux appartenait ont été modifiés afin de mieux tenir compte des quatre nouveaux niveaux d’amélioration des bienfaits thérapeutiques. Ainsi, un nouveau produit médicamenteux breveté qui, d’après les résultats de l’examen scientifique auquel il a été soumis, est considéré comme une amélioration thérapeutique modeste bénéficiera au moment de l’examen du prix d’une plus grande latitude au niveau de la conformité du prix. Cette plus grande latitude permettra de mieux tenir compte des petites améliorations apportées au produit médicamenteux au niveau de ses bienfaits thérapeutiques.
Comparaison du prix du produit médicamenteux au Canada avec son prix international le plus élevé – Le prix de lancement de tout nouveau produit médicamenteux breveté est désormais soumis à cette comparaison au niveau national et ce, pour les ventes faites aux pharmacies et aux hôpitaux (mais non aux grossistes) et pour chaque province ou territoire. Dans le cas d’un produit médicamenteux breveté existant, la comparaison du prix au Canada avec son prix international le plus élevé n’est effectuée qu’au niveau national sauf lorsque le prix de transaction moyen national justifie une enquête. L’exception des ventes aux grossistes a été ajoutée du fait que la comparaison du prix au Canada avec le prix international le plus élevé pouvait difficilement être appliquée aux produits médicamenteux génériques brevetés (en raison de la nature des prix des produits médicamenteux génériques) et que le Conseil souhaitait assurer une application juste et uniforme du test à tous les brevetés.
Comparaison du prix du produit médicamenteux au Canada selon sa catégorie thérapeutique internationale – À la différence des anciennes Lignes directrices, les nouvelles Lignes directrices contiennent une méthodologie de comparaison du prix du produit médicamenteux au Canada selon sa catégorie thérapeutique internationale. Ce test, qui n’est toutefois pas considéré essentiel, peut être appliqué dans le cadre d’une enquête aux fins d’éclairer le processus de prise de décisions. De plus, dans le cadre d’une audience publique, le Conseil est tenu de tenir compte dans son analyse de tous les facteurs mentionnés dans l’article 85(1) de la Loi, ce que permet les deux méthodologies d’application de ce test, à savoir l’approche du ratio et l’approche de la catégorie directe. Ces deux approches sont appliquées avec les mêmes produits de comparaison que ceux utilisés pour la comparaison des prix selon la catégorie thérapeutique au Canada. Lorsque la comparaison des prix selon la catégorie thérapeutique au Canada inclut dans son échantillonnage des produits médicamenteux génériques, l’échantillonnage de produits de comparaison ne sera alors constitué que de produits génériques vendus par des sociétés qui vendent le même produit générique au Canada.
Sélection des prix pour la comparaison – Les nouvelles Lignes directrices prévoient une nouvelle méthodologie de sélection des prix des produits médicamenteux aux fins de la comparaison de prix. Pour déterminer le prix d’un produit médicamenteux retenu pour la comparaison du prix, les nouvelles Lignes directrices présentent maintenant les sources de prix accessibles au public à consulter et que le personnel du Conseil consulte pour déterminer le prix le plus bas accessible au public. C’est le prix le plus élevé qui constitue le prix « de référence » de la comparaison du prix du produit médicamenteux selon sa catégorie thérapeutique. Cette modification a été apportée pour rendre le processus d’examen du prix encore plus transparent et ses résultats plus prévisibles pour les brevetés.
Examen du prix sur tout marché – Des explications ont été ajoutées concernant la façon dont sont effectués les examens de prix sur un marché. Les prix moyens des nouveaux produits médicamenteux brevetés qui viennent d’être lancés sur un marché canadien feront l’objet d’un examen au niveau national ainsi qu’au niveau de son sous-marché (pharmacie, hôpital, grossiste et province/territoire). Les prix sur les sous-marchés des produits médicamenteux existants ne sont soumis à un examen que lorsqu’une enquête semble justifiée. Cette explication a été ajoutée aux Lignes directrices en raison de la position du Conseil selon laquelle un certain niveau d’enquête sur le prix sur un marché relève du mandat dont l’investit la Loi sur les brevets. Dans le cours du processus de consultation, on a dit craindre que les prix sur certains marchés puissent être excessifs.
Méthodologie de la majoration – Des explications ont été ajoutées concernant l’utilisation de la méthodologie de la majoration qui prévoit des exceptions à la méthodologie de rajustement du prix du produit médicamenteux selon l’IPC lorsque le prix d’un produit médicamenteux apparaît excessif suite à la cessation ou à la réduction d’un avantage. Lorsque la méthodologie de la majoration est utilisée, le prix moyen sur un marché peut, moyennant présentation d’éléments de preuve, être porté au prix moyen non excessif le plus élevé du produit sur un autre marché. L’utilisation de la méthodologie de la majoration est assujettie à certains critères, mais l’objectif visé est de prévenir une situation où les brevetés n’auraient plus aucun intérêt à offrir certains avantages à leurs clients.
Politique concernant le remboursement des recettes excessives – Une nouvelle politique explique comment les brevetés doivent rembourser les recettes excessives qu’ils tirent de la vente de leurs produits à des prix excessifs. Cette politique a été adoptée nommément pour se conformer à l’article 83 de la Loi qui prévoit que les recettes excessives doivent être remboursées au moyen d’une réduction du prix du produit (ou d’un paiement au Trésor).
Nouvelle terminologie – Pour les nouveau produits médicamenteux brevetés, l’expression « Prix maximum non excessif au moment du lancement » a été remplacée par « Prix moyen maximal potentiel ». Pour les produits médicamenteux existant, l’expression « Prix maximum non excessif » a été remplacée par « Prix moyen non excessif ». Ce changement vise à mieux faire comprendre que la Loi prévoit que le mandat du Conseil s’applique aux « prix moyens » des produits médicamenteux sur différents marchés.
LES PROCHAINES ÉTAPES
Les nouvelles Lignes directrices du Conseil sont entrées en vigueur le 1er janvier 2010. Dans une perspective d’avenir, le Conseil souhaite rendre l’exercice de son mandat de réglementation encore plus prévisible, plus juste et plus transparent. À cette fin, il fera le suivi et l’évaluation de l’application des principaux changements apportés à ses Lignes directrices afin de s’assurer qu’elles continueront d’être pertinentes et appropriées à l’environnement pharmaceutique.
RAPPORTS SUR LES PRINCIPALES TENDANCES, 2009
VENTES DES PRODUITS MÉDICAMENTEUX BREVETÉS
En vertu du Règlement sur les médicaments brevetés, les brevetés doivent faire rapport au CEPMB de leurs ventes de produits médicamenteux brevetés au Canada, à savoir les quantités vendues, les recettes nettes et les prix moyens par produit médicamenteux, par catégorie de clients et par province/territoire. Le CEPMB utilise ces éléments d’information dans ses analyses des tendances aux niveaux des ventes, des prix et de l’utilisation faite des produits médicamenteux brevetés.3
VENTES ET PRIX
La population canadienne consacre aujourd’hui une partie beaucoup plus grande de son budget à l’achat de produits médicamenteux qu’elle ne le faisait il y a une dizaine d’années. Il est toutefois important de préciser qu’une augmentation des dépenses en produits médicamenteux n’est pas nécessairement attribuable à une augmentation des prix. Selon les rapports annuels des années 1995 à 2003, la valeur des ventes de produits médicamenteux brevetés a augmenté de plus de 10 % par année, alors que les taux moyens de variation des prix n’atteignaient même pas 1 %. Dans ces cas, ce sont le volume et la composition de l’utilisation faite des produits médicamenteux qui sont à l’origine de la croissance de la valeur des ventes4. Différents facteurs peuvent être à l’origine de tels changements, dont les suivants :
- augmentation de la population du pays
- variations de la composition démographique de la population (par ex. vieillissement de la population et, partant, une plus grande incidence de problèmes de santé)
- plus grande incidence des problèmes de santé nécessitant une pharmacothérapie
- nouvelles pratiques d’ordonnance des médecins (par ex. tendance à prescrire des nouveaux produits médicamenteux pour traiter une condition qui était jusque-là traitée avec des produits existants souvent vendus à moindre prix ou ordonnance de concentrations plus fortes et (ou) plus fréquentes)
- recours plus régulier à des pharmacothérapies en remplacement d’autres formes de traitement
- recours à de nouveaux produits médicamenteux pour traiter des conditions pour lesquelles il n’existait pas encore un traitement efficace.
TENDANCES OBSERVÉES AU NIVEAU DES VENTES
Le tableau 9, à la page 21, présente la valeur des ventes au Canada des produits médicamenteux brevetés pour les années 1990 à 2009. Les ventes de produits médicamenteux brevetés ont totalisé 13,3 milliards de dollars en 2009, soit 2,8 % de plus qu’en 2008 où ce montant totalisait 13,0 milliards de dollars. En guise de comparaison, le taux annuel de croissance des ventes de produits médicamenteux brevetés était de 27,0 % en 1999 et s’est maintenu dans les deux chiffres jusqu’en 2003.
La troisième colonne du tableau 9 présente la valeur des ventes des produits médicamenteux brevetés exprimée en pourcentage de la valeur des ventes de tous les produits médicamenteux brevetés et non brevetés. Entre 1990 et 2003, le pourcentage de la valeur des ventes de produits médicamenteux brevetés par rapport à la valeur des ventes de tous les produits médicamenteux est passé de 43,2 % à 72,7 %. Ce pourcentage ayant toutefois reculé depuis 2003, il apparaît que les ventes des produits médicamenteux de marque non brevetés et des produits médicamenteux génériques ont augmenté davantage au cours de cette période que celles de produits médicamenteux brevetés.
3 Les résultats statistiques présentés dans le présent chapitre se fondent sur les données que les brevetés ont soumises au CEPMB en date d’avril 2010. Il arrive que des brevetés soumettent un nouveau rapport révisant les données présentées ou contenant des données qui n’avaient pas été présentées dans un rapport antérieur. Ces données peuvent modifier d’une façon assez importante les statistiques utilisées pour la préparation du présent chapitre du rapport annuel. Pour tenir compte d’une telle éventualité, le CEPMB révise le calcul des données sur les ventes (voir la section « Ventes des produits médicamenteux brevetés », à la page 20). Il fait aussi rapport du calcul révisé des indices de prix et de quantité (voir la section « Tendances observées au niveau des prix », à la page 22, ainsi que la section « Utilisation faite des produits médicamenteux brevetés », à la page 31, des ratios des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada dans la section « Comparaison des prix pratiqués au Canada avec ceux pratiqués dans les pays de comparaison » à la page 27). Ces calculs couvrent les cinq années précédant l’année sur laquelle porte le présent rapport annuel. Les nouvelles valeurs ainsi obtenues reflètent les données courantes disponibles. En conséquence, lorsque la révision des données a été faite, les valeurs rapportées dans le présent rapport peuvent être différentes de celles présentées dans des rapports annuels antérieurs.
4 Selon les études menées par le CEPMB sur les régimes publics d’assurance-médicaments, c’est l’augmentation de l’utilisation faite des produits médicamenteux existants et des nouveaux produits médicamenteux qui est à l’origine de la majeure partie de la croissance des dépenses récemment enregistrée. Voir le document portant l’intitulé « Rapport sommaire des tendances des produits pharmaceutiques : 1997-1998 à 2003-2004 » publié en juin 2006.
TABLEAU 9 Ventes de produits médicamenteux brevetés, 1990-2009
| Année |
Produits médicamenteux brevetés |
Ventes de produits médicamenteux brevetés (% des ventes de tous les produits médicamenteux)5 |
| Ventes (milliards $) |
Variation (%) |
| 2009 |
13.3 |
2.8 |
62.4 |
| 2008 |
13.0 |
4.9 |
64.7 |
| 2007 |
12.4 |
3.3 |
65.4 |
| 2006 |
12.0 |
3.7 |
67.8 |
| 2005 |
11.5 |
4.7 |
70.6 |
| 2004 |
11.0 |
8.6 |
72.2 |
| 2003 |
10.2 |
14.3 |
72.7 |
| 2002 |
8.9 |
17.5 |
67.4 |
| 2001 |
7.6 |
18.9 |
65.0 |
| 2000 |
6.3 |
16.7 |
63.0 |
| 1999 |
5.4 |
27.0 |
61.0 |
| 1998 |
4.3 |
18.9 |
55.1 |
| 1997 |
3.7 |
22.6 |
52.3 |
| 1996 |
3.0 |
12.8 |
45.0 |
| 1995 |
2.6 |
10.8 |
43.9 |
| 1994 |
2.4 |
-2.1 |
40.7 |
| 1993 |
2.4 |
9.4 |
44.4 |
| 1992 |
2.2 |
14.0 |
43.8 |
| 1991 |
2.0 |
13.1 |
43.2 |
| 1990 |
1.7 |
– |
43.2 |
Sources : CEPMB et IMS Health
FACTEURS À LA SOURCE DE LA CROISSANCE DES VENTES
Le tableau 10 décompose en différents éléments la croissance des ventes enregistrée entre 2008 et 2009. Ces éléments sont les suivants :
- produits médicamenteux brevetés dont le brevet est arrivé à échéance ou dont le brevet a été cédé au domaine public (« Effet du retrait du médicament »)
- produits médicamenteux brevetés lancés sur le marché canadien en 2009 (« Effet du nouveau médicament »)
- variations des prix des produits médicamenteux brevetés vendus au Canada en 2008 et en 2009 (« Effet du prix »)
- écarts de quantités vendues de ces produits médicamenteux en 2008 et en 2009 (« Effet du volume »)
- interactions des variations de prix et de quantité (« Effets croisés »).
La première rangée du tableau 10 présente les incidences d’après leur valeur monétaire et la deuxième rangée les présente au moyen de la variation des ventes en 2009 par rapport à 2008. Pour des fins de comparaison, la troisième rangée présente les incidences avec les taux moyens de variation annuelle des ventes pour la période de 2004 à 2008.6
Les résultats de ce tableau révèlent que l’augmentation des ventes observée en 2009 par rapport à 2008 était essentiellement attribuable aux augmentations des quantités vendues de produits médicamenteux brevetés existants et de nouveaux produits médicamenteux brevetés. L’effet de volume a largement compensé l’effet important (négatif) de retrait du produit médicamenteux du marché. Les augmentations de prix des produits médicamenteux existants n’est à la source que de 5,2 % de l’augmentation des dépenses en produits médicamenteux.
TABLEAU 10 Décomposition des variations des ventes des produits médicamenteux brevetés
| |
Variation totale |
Effet du retrait du médicament |
Effet du nouveau médicament |
Effet du prix |
Effet du volume |
Effets croisés |
| Incidence sur le revenu net, 2009/2008 (millions $) |
368,8 |
-250,1 |
149,.1 |
19,.3 |
440,8 |
11,.9 |
| Proportion la variation totale, 2009/2008 (%) |
100,.0 |
-67,8 |
40,.4 |
5,2 |
119,5 |
3,2 |
| Proportion moyenne de la variation totale, 2004–2008 (%) |
100,0 |
-54,9 |
47,.4 |
0,2 |
105,6 |
1,.7 |
Source : CEPMB
Les résultats de la décomposition des ventes de 2009 s’inscrivent dans les moyennes historiques observées dans le tableau 10. D’une façon plus précise, l’effet dominant du volume et les effets relativement modestes du prix observés en 2009 sont tout à fait représentatifs.
Le recul marqué des taux de croissance des ventes au cours des dernières années est pour le moins surprenant. Au cours de la dernière partie des années 1990, la croissance des ventes a été associée à une succession de nouveaux médicaments « vedettes » qui ont donné lieu à des volumes de ventes très élevés. Toutefois, depuis le début des années 2000, le nombre de nouveaux médicaments « vedettes » n’a pas été suffisant pour soutenir un taux de croissance dans les deux chiffres. Le graphique 4 présente pour 2009 une ventilation des ventes de produits médicamenteux brevetés selon l’année de leur première vente au Canada. Les ventes sont réparties presque également entre les produits médicamenteux lancés sur le marché avant l’année 2000 et ceux lancés sur le marché par la suite. Les produits médicamenteux brevetés lancés sur le marché canadien entre 1995 et 1999 sont aujourd’hui encore à la source de 35,9 % des ventes.
VENTES SELON LA CATÉGORIE THÉRAPEUTIQUE
Pour ses analyses de prix au niveau du groupe thérapeutique, le CEPMB classe généralement les produits médicamenteux à l’aide du Système de classification anatomique, thérapeutique, chimique (ATC) de l’Organisation mondiale de la santé (OMS). Ce système hiérarchique classe les produits médicamenteux selon leur utilisation thérapeutique principale et leur composition chimique. Au plus haut niveau de ce système, à savoir au niveau 1, le système ATC classe les médicaments selon la partie de l’anatomie à laquelle ils sont principalement associés.
Le tableau 11 ventile les ventes des produits médicamenteux brevetés effectuées au Canada en 2009 selon le groupe thérapeutique principal, à savoir le premier niveau de la classification ATC. Il présente les ventes effectuées en 2009 dans les différents groupes de produits médicamenteux, leur part de l’ensemble des ventes ainsi que le taux d’augmentation de la valeur de leurs ventes par rapport à 2008. Les valeurs présentées dans la dernière colonne correspondent à la composante de la croissance de l’ensemble des ventes attribuables aux produits médicamenteux du groupe thérapeutique7. La mesure ainsi obtenue permet de dégager que ce sont les agents antinéoplasiques et immunomodulateurs qui, en 2009, ont le plus contribué à la croissance de la valeur des ventes par rapport à 2008. Les médicaments de cette catégorie sont à l’origine de la presque totalité de l’augmentation des ventes.
5 Le dénominateur dans ce ratio comprend la valeur des ventes des produits médicamenteux de marque brevetés, des produits médicamenteux de marque non brevetés et des produits médicamenteux génériques. L’estimé de la valeur totale des ventes utilisé pour calculer le ratio de 2005 se fonde sur les données tirées de la base de données MIDAS de IMS Health. Pour les années antérieures, les données d’IMS Health n’ont été utilisées que pour calculer la valeur des ventes des produits médicamenteux génériques. Quant à la valeur des ventes des produits médicamenteux de marque non brevetés, elle était alors estimée à l’aide des données fournies par les brevetés. Pour mettre un terme aux anomalies attribuables aux variations annuelles de la liste des brevetés, le CEPMB n’utilise plus que les données d’IMS. Les ratios rapportés dans le tableau pour les années 2004 et antérieures gonflaient légèrement la part des produits médicamenteux brevetés. Ce léger écart n’invalide toutefois pas la forte tendance à la hausse observée pour les années 1990 à 2004.
6 Dans le présent cas, l’« effet de retrait du médicament » correspond au montant des ventes générées en 2009 par les produits médicamenteux qui étaient assujettis à la compétence du CEPMB en 2008, mais non en 2009. L’« effet du nouveau médicament » correspond au montant des ventes générées en 2009 par les produits médicamenteux qui étaient assujettis à la compétence du CEPMB en 2009, mais non en 2008. Les autres effets sont calculés au moyen de la relation suivante : Ó p2009(i) q2009(i) - Ó p2008(i) q2008(i) = Ó [p2009(i) - p2008(i)]q2008(i) + Ó p2008(i) [q2009(i) - q2008(i)] + Ó [p2009(i) - p2008(i)] [q2009(i) - q2008(i)]
où py(i) correspond au prix du produit médicamenteux « i » l’année « y », qy(i) au volume physique du produit médicamenteux « i » vendu l’année « y » et Ó à la somme des produits médicamenteux qui étaient assujettis à la compétence du CEPMB en matière d’examen du prix pour les années 2008 et 2009. La partie gauche de l’équation représente la variation des ventes de ces produits médicamenteux en 2009 par rapport à 2008. Du côté droit de l’équation, les trois termes définissent respectivement l’effet de volume, l’effet de prix et les effets croisés. Ces effets sont présentés dans le tableau 10.
7 Ratio de la variation annuelle de la valeur monétaire des ventes des produits médicamenteux de cette catégorie thérapeutique par rapport à la variation de la valeur des ventes de tous les produits médicamenteux brevetés.
TENDANCES OBSERVÉES AU NIVEAU DES PRIX
Le CEPMB compile l’Indice des prix des médicaments brevetés (IPMB). Cet indice nous permet d’observer les tendances des prix des produits médicamenteux brevetés. L’IPMB mesure la variation moyenne des prix auxquels les brevetés vendent leurs produits médicamenteux brevetés sur le marché canadien (prix départ-usine) par rapport à l’année précédente. L’indice est calculé à l’aide de la formule qui correspond à la moyenne de la variation des prix au niveau du produit médicamenteux pondérée en fonction des ventes8. La méthodologie utilisée rappelle celle qu’utilise Statistique Canada pour compiler l’indice des prix à la consommation (IPC). L’IPMB est actualisé à chaque semestre à partir des données sur les prix et sur les ventes dont les brevetés font rapport au Conseil.9
TABLEAU 11 Ventes des produits médicamenteux brevetés selon leur groupe thérapeutique principal, 2009
| Groupe thérapeutique principal |
Ventes en 2009 (millions $) |
Part des ventes en 2009 (%) |
Croissance : 2009/2008
(millions $) |
Croissance : 2009/2008
(%) |
Part de la croissance des ventes(%) |
| A : Tube digestif et métabolisme |
1 095,4 |
8,2 |
-179,2 |
-14,1 |
-48,6 |
| B : Sang et organes sanguinoformateurs |
872 7 |
6,5 |
-9,4 |
-1,1 |
-2,6 |
| C : Système cardiovasculaire |
3 267,9 |
24,5 |
93,6 |
2,9 |
25,4 |
| D : Produits dermatologiques |
104,0 |
0,8 |
-17,2 |
-14,2 |
-4,7 |
| G : Système génito-urinaire et hormones sexuelles |
546,0 |
4,1 |
44,8 |
8,9 |
12,2 |
| H : Préparations hormonales systémiques |
94,9 |
0,7 |
3,0 |
3,3 |
0,8 |
| J : Antiinfectieux généraux pour usage systémique; P : Produits antiparasitaires** |
1 363,7 |
10,2 |
-20,8 |
-1,5 |
-5,6 |
| L : Agents antinéoplasiques et agents immunomodulateurs |
2 387,6 |
17,9 |
357,1 |
17,6 |
96,9 |
| M : Système musculo-squelettique |
524,6 |
3,9 |
5,6 |
1,1 |
1,5 |
| N : Système nerveux |
1 639,4 |
12,3 |
2,0 |
0,1 |
0,6 |
| R : Système respiratoire |
1 070,1 |
8,0 |
54,4 |
5,4 |
14,7 |
| S : Organes sensoriels |
303,4 |
2,3 |
34,7 |
12,9 |
9,4 |
| Tous les groupes thérapeutiques |
64,2 |
0,5 |
0,0 |
0,1 |
0,0 |
| All Therapeutic Classes |
13 334,0 |
100,0* |
368,6 |
2,8 |
100,0 |
* Le total de cette colonne peut ne pas correspondre exactement à 100,0 du fait que certains chiffres ont été arrondis. ** Pour des raisons de confidentialité, les données de ces deux groupes ont été combinées.
Source : CEPMB
Il est important de bien comprendre la relation théorique qui existe entre l’IPMB et les coûts des produits médicamenteux. L’IPMB ne mesure pas les effets des changements de l’utilisation faite des produits médicamenteux. Cette mesure est prise par un autre indice appelé l’indice du volume des ventes de médicaments brevetés – l’IVVMB (voir à la page 31 « Utilisation faite des produits médicamenteux brevetés »). L’IPMB ne mesure pas non plus l’incidence sur les coûts des nouvelles habitudes d’ordonnance des médecins ou de l’arrivée sur le marché de nouveaux produits médicamenteux. L’IPMB est conçu pour isoler la composante de variation des ventes attribuable aux variations des prix des produits médicamenteux brevetés.
Le graphique 5 présente les variations annuelles de l’IPMB pour les années 1988 à 2009. Selon la mesure prise par l’IPMB, les prix départ-usine des produits médicamenteux brevetés ont augmenté en moyenne de 0,3 % en 2009 par rapport à 2008.
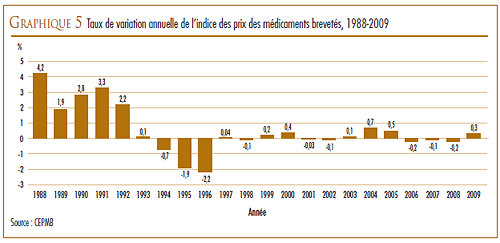
La Loi sur les brevets prévoit que le CEPMB doit tenir compte des variations de l’indice des prix à la consommation (IPC) lorsqu’il est appelé à déterminer si le prix d’un médicament breveté est ou non excessif. Le graphique 6 présente les variations annuelles de l’IPMB par rapport aux variations de l’IPC pour les mêmes années. L’inflation des prix, mesurée au moyen de l’IPC, a été supérieure à l’augmentation moyenne des prix des produits médicamenteux brevetés presque chaque année depuis 1988. En 2009, le taux d’augmentation de l’IPMB a été le même que celui de l’inflation mesurée à l’aide de l’IPC (taux inhabituellement bas).10
Il n’est pas surprenant que l’IPMB ait rarement augmenté au même rythme que l’IPC. Les Lignes directrices du Conseil prévoient en effet que les prix des produits médicamenteux brevetés ne peuvent augmenter davantage que le taux moyen d’augmentation de l’indice des prix à la consommation calculé sur une période de trois ans. (Les Lignes directrices limitent également les augmentations annuelles de prix à une fois et demie le taux d’inflation calculé à l’aide de l’IPC.) Cette exigence a pour effet de limiter les augmentations des prix des produits à celles de l’IPC sur une période d’au moins trois années11. En pratique, les variations de l’IPC n’atteignent jamais cette limite étant donné que certains brevetés n’augmentent pas les prix de leurs médicaments dans toute la mesure autorisée par les Lignes directrices du CEPMB, lorsqu’ils ne les réduisent pas.

VARIATION DU PRIX SELON LE GROUPE THÉRAPEUTIQUE
Le tableau 12, à la page 25, présente les taux moyens de variation des prix des produits médicamenteux brevetés selon leur groupe thérapeutique principal. Ce tableau a été établi en appliquant la méthode de calcul de l’IPMB aux données sur les prix des différents produits médicamenteux brevetés ventilées selon le groupe thérapeutique principal (niveau 1 de la classification ATC). La dernière colonne du tableau présente le résultat de la décomposition de la variation globale de l’IPMB où chaque entrée représente la composante attribuable aux produits médicamenteux du groupe thérapeutique correspondant. Selon cette mesure, l’augmentation de 0,3 % de l’IPMB indique que les prix des produits médicamenteux des différentes catégories thérapeutiques sont relativement stables. En effet, toutes catégories thérapeutiques confondues, aucun groupe thérapeutique n’affiche en 2009 une augmentation moyenne du prix plus élevée que celle de l’inflation mesuré au moyen de l’IPC.12
TABLEAU 12 Variation de l’indice des prix des médicaments brevetés (IPMB) selon le groupe thérapeutique principal, 2009
| Groupe thérapeutique |
Pourcentage des ventes en 2009 (%) |
Variation des prix en 2009 par rapport à 2008 (%) |
Croissance (2009 par rapport à 2008) |
| A : Tube digestif et métabolisme |
8,2 |
-1,1 |
-0,1 |
| B : Sang et organes sanguinoformateurs |
6,5 |
0,1 |
0,0 |
| C : Système cardiovasculaire |
24,5 |
0,6 |
0,2 |
| D : Produits dermatologiques |
0,8 |
0,7 |
0,0 |
| G : Système génito-urinaire et hormones sexuelles |
4,1 |
0,8 |
0,0 |
| H : Préparations hormonales systémiques |
0,7 |
0,6 |
0,0 |
| J : Antiinfectieux généraux pour usage systémique; P : Produits antiparasitaires** |
10,2 |
1,7 |
0,2 |
| L : Agents antinéoplasiques et agents immunomodulateurs |
17,9 |
0,6 |
0,1 |
| M : Système musculo-squelettique |
3,9 |
-0,8 |
0,0 |
| N : Système nerveux |
12,3 |
0,2 |
0,0 |
| R : Système respiratoire |
8,0 |
1,1 |
0,1 |
| S : Organes sensoriels |
2,3 |
0,3 |
0,0 |
| V : Divers |
0,5 |
-9,3 |
0,0 |
| Tous les groupes thérapeutiques |
100,0* |
0,3 |
0,3 |
* Le total de cette colonne peut ne pas correspondre exactement à 100,0 du fait que certains chiffres ont été arrondis. ** Pour des raisons de confidentialité, les données sur ces deux groupes ont été combinées.
Source : CEPMB
VARIATION DES PRIX SELON LA CATÉGORIE DE CLIENTS
Le graphique 7 présente les taux moyens de variation des prix selon la catégorie de clients13. Ces taux ont été obtenus en appliquant la méthodologie de l’IPMB aux données sur les ventes faites aux hôpitaux, aux pharmacies et aux grossistes14. Pour 2009, les taux de variation des prix sont de -1,4 % pour les hôpitaux, 2,0 % pour les pharmacies et 0,4 % pour les grossistes.
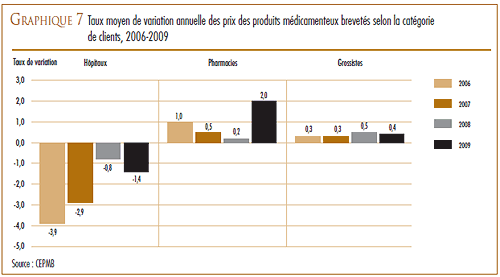
VARIATION DES PRIX SELON LA PROVINCE OU LE TERRITOIRE
Le graphique 8 présente les taux moyens de variation des prix des produits médicamenteux brevetés selon la province ou le territoire. Ces taux ont été obtenus en appliquant la méthodologie du calcul de l’IPMB aux données sur les prix ventilées selon la province ou le territoire dans lequel les ventes ont été effectuées. Ces résultats révèlent que, entre 2008 et 2009, les prix des produits médicamenteux brevetés ont reculé dans l’Île-du-Prince-Édouard, au Québec, au Manitoba, dans les Territoires du Nord-Ouest et au Yukon. C’est à Terre-Neuve-et-Labrador (1,7 %), en Alberta (1,2 %) et au Nouveau-Brunswick (1 %) que les variations moyennes ont été les plus marquées.
VARIATION DU PRIX D’UN PRODUIT MÉDICAMENTEUX BREVETÉ DANS LES ANNÉES QUI SUIVENT SON LANCEMENT SUR LE MARCHÉ CANADIEN
Le prix d’un produit médicamenteux breveté varie-t-il beaucoup au cours des années qui suivent son lancement sur le marché canadien? Le graphique 9 répond à cette question en présentant le ratio moyen des prix de vente des produits médicamenteux en 2009 par rapport aux prix auxquels ils ont été offerts au moment de leur lancement sur le marché canadien. Le graphique présente les ratios pour les produits médicamenteux lancés sur le marché chaque année commençant en 1995 et années suivantes.
Les résultats présentés dans le graphique 9 ne révèlent pas une tendance à la hausse ou à la baisse des prix après la période de lancement des produits médicamenteux sur le marché canadien. En 2009, le prix d’un produit médicamenteux breveté se situait dans une marge de quelques points de son prix de lancement et ce, pour toute année de lancement du produit médicamenteux sur le marché canadien.15
VARIATION DES PRIX SELON LE PAYS
La Loi et le Règlement obligent les brevetés à faire rapport au CEPMB des prix de leurs produits médicamenteux brevetés accessibles au public qu’ils pratiquent dans les sept pays de comparaison nommés dans le Règlement. Ces pays sont la France, l’Allemagne, l’Italie, la Suède, la Suisse, le Royaume-Uni et les États-Unis. Le CEPMB utilise ces données aux fins suivantes :
- pour effectuer ses comparaisons des prix internationaux prévues dans les Lignes directrices et
- pour comparer les prix des produits médicamenteux pratiqués au Canada avec les prix pratiqués dans d’autres pays.
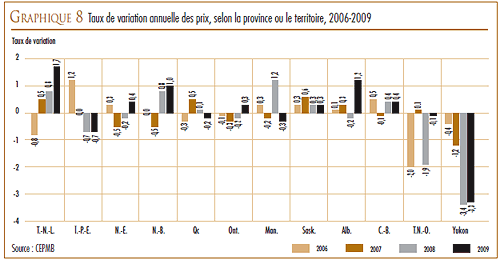
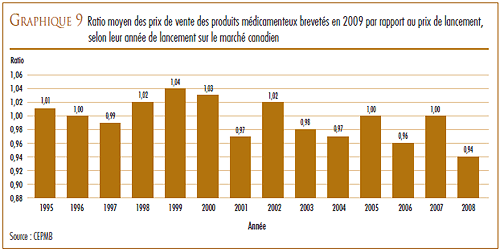
Le graphique 10 présente les taux moyens de variation annuelle des prix pour le Canada et pour les sept pays de comparaison. Ces valeurs ont été obtenues en appliquant la méthodologie de l’IPMB (avec pondération pour tenir compte des tendances des ventes au Canada) aux données sur les prix pratiqués dans les différents pays de comparaison soumises par les brevetés. À titre d’information, deux résultats sont présentés pour les États-Unis : le premier résultat porte exclusivement sur les prix du marché (à savoir les coûts d’acquisition au prix de gros)16 déclarés par les brevetés alors que le deuxième tient compte des prix de la Classification fédérale des approvisionnements (US Federal Supply Schedule ou FSS) également déclarés par les brevetés1.17
Selon le graphique 10, les prix des produits médicamenteux brevetés aux États-Unis ont augmenté en 2009 d’un taux moyen de 8 à 9 %. Les augmentations de prix ont été beaucoup plus modestes en Italie, en Allemagne, en Suède et aux États-Unis alors que les prix en France et en Suisse ont enregistré un léger recul.

8 Pour la majeure partie, au niveau défini par le numéro d’identification de drogue (DIN) attribué par Santé Canada. Chaque DIN représente une combinaison unique d’ingrédients actifs, de forme(s) posologique(s) et de concentration(s).
9 Pour comprendre comment est calculé l’IPMB, voir le document du CEPMB intitulé « Description de la méthodologie de l’indice-chaîne Laspeyres utilisée pour calculer l’indice des prix des médicaments brevetés (IPMB), juin 2000. Depuis 1999, l’IPMB ne porte que sur les variations des prix des produits médicamenteux brevetés pour usage humain.
10 Statistique Canada, CANSIM, Série V735319. Pour 2009, les prix à la consommation ont augmenté de 0,3 %, ce qui représente une augmentation beaucoup moins marquée que celle de 2,3 % enregistrée en 2008 et que l’augmentation de 2,0 % prévue pour 2009. L’augmentation réelle de l’IPC de 2009 (0,3 %) est la plus basse augmentation enregistrée depuis celle de 1994 (0,1 %).
11 Les prix des produits médicamenteux (et donc l’IPMB) peuvent au cours d’une année donnée augmenter davantage que l’IPC. Cette situation peut se produire lorsque les brevetés n’ont pas appliqué les deux dernières augmentations annuelles de prix auxquelles ils avaient droit. Elle peut également se produire lorsque le taux prévu d’inflation/IPC se révèle plus élevé que le taux réel. Pour faciliter et encourager la conformité des brevetés, la méthodologie de rajustement du prix selon l’IPC du CEPMB utilise les prévisions du taux d’inflation/IPC publiées par le ministère des Finances. Les brevetés doivent suivre les règles de rajustement du prix du CEPMB qui tiennent compte du taux prévu ou du taux réel d’inflation/IPC. Lorsque le taux d’inflation/IPC prévu se révèle plus élevé que le taux d’inflation/IPC réel de l’année en question, les augmentations de prix peuvent être plus élevées que le taux d’inflation/IPC. Toutefois, le gain du breveté ne sera pas permanent du fait que la règle de rajustement du prix des trois dernières années ramènera éventuellement l’augmentation du prix cumulatif au niveau du taux d’inflation/IPC cumulatif (réel).
12 R représente le taux général de variation de l’IPMB et N, les groupes thérapeutiques nommés 1,2…N. R(i) représente le taux moyen de variation du prix du groupe thérapeutique principal i obtenu avec la méthodologie de l’IPMB. R étant une moyenne des variations des prix de tous les produits médicamenteux pondérée en fonction de la valeur des ventes, il devient facile de calculer la relation suivante :
R = w(1) x R(1) + w(2) x R(2) + … + w(N) x R(N),
où w(i) représente la part du groupe thérapeutique principal de l’ensemble des ventes. Cette dernière équation constitue la base de la décomposition par groupe thérapeutique présentée à la dernière colonne du tableau 12. Chaque terme du côté droit multiplie le taux moyen de variation du prix pour un groupe thérapeutique donné par sa part de l’ensemble des ventes. La valeur ainsi obtenue peut facilement être considérée comme la contribution correspondante du groupe thérapeutique à la variation de l’IPMB. L’envergure de cette contribution dépend du taux de variation du prix pour le groupe thérapeutique en question et de son importance relative (mesurée par sa part de l’ensemble des ventes).
La décomposition dans le tableau 12 est approximative étant donné que les pondérations utilisées pour calculer la contribution de chaque groupe thérapeutique sont tirées des données sur les ventes annuelles alors que le taux de variation du prix (pour l’ensemble des groupes thérapeutiques ou pour chaque groupe thérapeutique) est calculé avec des données couvrant des périodes de six mois. L’écart obtenu est généralement très minime.
13 Ce sont les grossistes qui accaparent la part du lion des ventes de produits médicamenteux brevetés avec 80,4 % de l’ensemble des ventes effectuées en 2009. Les hôpitaux sont à l’origine de 8,7 % des ventes et les ventes directes aux pharmacies de 3,7 %. Depuis 2001, les ventes aux pharmacies de produits médicamenteux brevetés ont subi une baisse draconienne, passant de 20,1 % qu’elles étaient en 2001 à 3,7 % en 2009.
14 Les résultats pour une quatrième catégorie de clients, la catégorie « autres », ne sont pas fournis. En 2009, cette catégorie a été à la source d’environ 7,2 % de toutes les ventes de produits médicamenteux brevetés. Les acheteurs de la catégorie « autres » sont essentiellement des éta - blissements de soins de santé autres que les hôpitaux, notamment des cliniques médicales et des centres de soins infirmiers, mais également les gouvernements. Étant donné que la composition de cette catégorie de clients varie beaucoup d’année en année, son analyse des variations de prix apparaît plus ou moins utile.
15 Ce constat fait référence au comportement des prix en général. Il existe sans aucun doute des cas où le prix d’un produit médicamenteux a augmenté ou baissé d’une façon marquée depuis son lancement sur le marché canadien.
16 L’expression « coût d’acquisition au prix de gros » (Wholesale Acquisition Costs – WAC) désigne le prix que le grossiste paie à son fournisseur qui est généralement le fabricant du médicament. Le coût d’acquisition au prix de gros accessible au public correspond habituellement au prix de liste du fabricant et ne reflète pas toujours tous les rabais et escomptes consentis par le fabricant.
17 L’industrie pharmaceutique des États-Unis a fait valoir que les prix accessibles au public dans ce pays ne reflètent pas vraiment les prix réels en raison des remises et des rabais consentis sur une base confidentielle. Depuis janvier 2000, dans la foulée d’une consultation publique, le CEPMB inclut les prix figurant dans la Classification fédérale des approvisionnements (Federal Supply Schedule ou FSS) des États-Unis dans son calcul des prix moyens des médicaments brevetés pratiqués aux États-Unis. Les prix de la Classification fédérale sont négociés entre les fabricants et le département des Anciens combattants des États-Unis. Ils sont généralement moins élevés que les autres prix accessibles au public pratiqués aux États-Unis et divulgués dans les rapports des brevetés au CEPMB.
COMPARAISON DES PRIX PRATIQUÉS AU CANADA AVEC CEUX PRATIQUÉS DANS LES PAYS DE COMPARAISON
Les tableaux 13 et 14 présentent des statistiques détaillées qui permettent de comparer les prix des produits médicamenteux pratiqués dans les sept pays de comparaison avec ceux pratiqués au Canada. Chaque tableau présente quatre séries de ratios de prix moyens. Ils sont différents l’un de l’autre selon (1) la formule de calcul de la moyenne utilisée et (2) la méthode de conversion en équivalents dollars canadiens des prix exprimés dans la devise des différents pays. Les deux tableaux présentent également le nombre de produits médicamenteux (DIN) et le volume des ventes couverts par chaque ratio de prix.18
Le CEPMB faisait jusqu’ici rapport des ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada sous forme de ratios calculés à l’aide des moyennes géométriques pondérées en fonction des ventes. Les résultats obtenus sont présentés dans les tableaux 13 et 14 (sous « Moyenne géométrique »). Ces tableaux présentent aussi les résultats obtenus avec une moyenne arithmétique pondérée en fonction du volume des ventes (sous « Moyenne arithmétique »)19. Ces statistiques permettent de répondre aux questions comme celle-ci :
« Combien les Canadiens auraient-ils payé, en plus ou en moins, leurs produits médicamenteux brevetés en 2009 s’ils les avaient achetés aux prix pratiqués dans le pays X? »20
Par exemple, vous pouvez voir dans le tableau 13 que le ratio du prix moyen en France par rapport au prix moyen au Canada calculé avec la moyenne arithmétique est de 0,90 pour 2009. Ce ratio signifie que les Canadiens auraient payé leurs médicaments brevetés 10 % de moins en 2009 s’ils avaient pu les acheter aux prix pratiqués en France.
Pendant bon nombre d’années, le CEPMB a fait rapport des ratios des prix moyens pratiqués dans les pays de comparaison par rapport aux prix moyens pratiqués au Canada après avoir converti les prix pratiqués dans les pays de comparaison en équivalents dollars canadiens à l’aide des moyennes des taux de change (ou, plus précisément, les moyennes mobiles des taux de change sur une période de 36 mois que le CEPMB utilise généralement lorsqu’il applique ses Lignes directrices).
Le tableau 13 compare également les ratios des prix des produits médicamenteux dans les pays de comparaison par rapport à leurs prix au Canada après avoir converti la devise à l’aide de la parité des pouvoirs d’achat. Le taux de parité des pouvoirs d’achat représente le coût de la vie relatif dans ces deux pays exprimé dans leurs devises respectives. En pratique, le coût de la vie est calculé à l’aide d’un panier de produits et de services aux prix courants. Étant donné que les taux de parité des pouvoirs d’achat représentent le coût de la vie dans chacun des pays, ils constituent un moyen simple de rajuster les prix pour tenir compte des différences de revenus et d’autres valeurs monétaires dans la comparaison des prix pratiqués dans les différents pays. Appliqués au calcul des ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, les taux de parité des pouvoirs d’achat fournissent des statistiques qui nous permettent de répondre à des questions comme celle-ci :
« Dans quelle mesure les Canadiens auraient-ils dû sabrer dans leur consommation de biens et de services pour acheter des produits médicamenteux brevetés ou, encore, auraient-ils pu augmenter leur consommation de biens et de services si, en 2009, ils avaient vécu et acheté leurs produits médicamenteux brevetés dans le pays X? »
On ne peut répondre à telle question en limitant la comparaison aux prix des produits médicamenteux. Il faut en effet calculer ce que chaque prix représente en termes de biens et de services sacrifiés. C’est précisément ce que permettent de faire les parités des pouvoirs d’achat.
TABLEAU 13 Ratios des prix moyens des produits médicamenteux brevetés pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, comparaisons bilatérales, 2009
Taux de change du marché
| |
Canada |
France |
Italie |
Allemagne |
Suède |
Suisse |
Royaume-Uni |
États-Unis |
| Moyenne géométrique |
1,00 |
0,84 |
0,80 |
1,08 |
0,93 |
0,98 |
0,90 |
1,71 |
| Moyenne arithmétique |
1,00 |
0,90 |
0,86 |
1,15 |
0,99 |
1,03 |
0,96 |
1,85 |
| Nbre de DIN |
1,180 |
762 |
765 |
868 |
851 |
817 |
855 |
992 |
| Revenus nets (millions $) |
13 334,0 |
11 606,8 |
10 884,6 |
11 811,4 |
11 915,2 |
11 827,4 |
11 728,6 |
12 661,1 |
Parité des pouvoirs d’achat
| |
Canada |
France |
Italie |
Allemagne |
Suède |
Suisse |
Royaume-Uni |
États-Unis |
| Moyenne géométrique |
1,00 |
0,72 |
0,73 |
0,98 |
0,76 |
0,74 |
0,81 |
1,85 |
| Moyenne arithmétique |
1,00 |
0,76 |
0,79 |
1,05 |
0,80 |
0,78 |
0,87 |
2,00 |
| Nbre de DIN |
1,180 |
762 |
765 |
868 |
851 |
817 |
855 |
992 |
| Revenus nets (millions $) |
13 334,0 |
11 606,8 |
10 884,6 |
11 811,4 |
11 915,2 |
11 827,4 |
11 728,6 |
12 661,1 |
COMPARAISONS BILATÉRALES DES PRIX
Le tableau 13 compare les prix pratiqués dans les sept pays de comparaison avec ceux pratiqués au Canada. D’après les résultats de la conversion des différentes devises aux taux de change du marché, les prix des produits médicamenteux brevetés pratiqués au Canada se situent encore dans la juste moyenne. Les prix en Italie et en France sont beaucoup moins élevés qu’au Canada. Comme dans les années antérieures, les prix des produits médicamenteux brevetés étaient encore en 2009 beaucoup plus élevés aux États-Unis qu’au Canada et que dans les autres pays de comparaison.
Les ratios moyens de prix obtenus suite à la conversion des devises aux taux de parité des pouvoirs d’achat (PPA) présentent au bas du tableau 13 des différences plus marquées entre le Canada et les pays de comparaison. Si l’on tient compte des différences du coût de la vie dans les sept pays de comparaison, le Canada apparaît comme le pays où les coûts de consommation pour les produits médicamenteux brevetés sont les plus élevés. En effet, ils donnent à penser que les Canadiens ont dû sacrifier en 2009 un taux beaucoup plus élevé de leur pouvoir d’achat pour se procurer des médicaments brevetés que n’ont dû le faire les consommateurs des pays de comparaison, exclusion faite des consommateurs de l’Allemagne et des États-Unis.
Le graphique 11 présente ces résultats dans une perspective historique. En 1998, les prix au Canada étaient généralement plus élevés que les prix pratiqués en France et en Italie, mais moins élevés que les prix pratiqués dans les cinq autres pays de comparaison. La situation n’a pas vraiment changé jusqu’en 2003. En 2009, les prix au Canada étaient généralement plus élevés que ceux pratiqués en Italie et en France, mais beaucoup moins élevés que ceux des États-Unis bien qu’à l’intérieur d’une marge de plus ou moins 10 % lorsque comparés aux prix pratiqués en Allemagne, en Suède, en Suisse et au Royaume-Uni.
RATIOS DES PRIX MOYENS DES PRODUITS MÉDICAMENTEUX BREVETÉS DANS LES PAYS DE COMPARAISON PAR RAPPORT AUX RATIOS MOYENS DES PRIX AU CANADA : ANALYSE DES VARIATIONS
Dans l’ensemble, les résultats des comparaisons avec les prix dans les pays de comparaison obtenus en 2009 sont très similaires à ceux dont faisait état le Rapport annuel de l’an dernier. Le changement le plus marqué touche les ratios moyens des prix des médicaments aux États-Unis par rapport à leurs prix au Canada calculés avec les taux de change du marché. Ces ratios sont beaucoup plus élevés en 2009 (de 1,63 en 2008 à 1,71 en 2009 lorsque calculés avec la moyenne géométrique et de 1,76 en 2008 à 1,85 en 2009 lorsque calculés avec la moyenne arithmétique). Considérant la façon dont sont calculés ces ratios, les cinq facteurs suivants peuvent être à l’origine des variations observées :
1. appréciation de la valeur du dollar canadien par rapport au dollar américain résultant de l’utilisation de nouveaux facteurs de conversion des devises
2. augmentation des prix pratiqués aux États-Unis
3. baisse des prix au Canada
4. changement du panier de produits médicamenteux qui, dans l’ensemble, favorise les produits qui affichent des ratios plus élevés des prix des produits médicamenteux brevetés pratiqués aux États-Unis par rapport aux prix pratiqués au Canada.
5. changement des pondérations en fonction des ventes qui favorise les médicaments affichant des ratios plus élevés des prix des produits médicamenteux brevetés pratiqués aux États-Unis par rapport aux prix pratiqués au Canada.
Selon une autre analyse, l’augmentation des ratios moyens des prix aux États-Unis par rapport aux prix au Canada est exclusivement attribuable à une hausse des prix des produits médicamenteux aux États-Unis. Les variations des pondérations des ventes ont atténué dans une certaine mesure l’incidence des augmentations des prix aux États-Unis. Par ailleurs, les variations d’autres facteurs ont eu une faible incidence sur les ratios moyens des prix.
COMPARAISONS MULTILATÉRALES DES PRIX
Le tableau 14 présente les ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada et ce, pour plusieurs mesures multilatérales des prix pratiqués dans les pays de comparaison. Le « prix international médian » correspond à la médiane des prix de vente des produits médicamenteux dans les sept pays de comparaison. D’autres ratios de prix multilatéraux comparent la moyenne minimale, maximale et simple des prix pratiqués dans les pays de comparaison par rapport aux prix au Canada.

TABLEAU 14 Ratios des prix moyens des produits médicamenteux brevetés dans les pays de comparaison par rapport aux prix moyens au Canada, comparaisons multilatérales, 2009
Taux de change du marché
| |
Médiane |
Minimum |
Maximum |
Moyenne |
| Moyenne géométrique |
0,98 |
0,73 |
1,85 |
1,11 |
| Moyenne arithmétique |
1,04 |
0,79 |
1,98 |
1,16 |
| Nbre de DIN |
1 112 |
1 112 |
1 112 |
1 112 |
| Revenus nets (millions $) |
13 044,6 |
13 044,6 |
13 044,6 |
13 044,6 |
Parité des pouvoirs d’achat
| |
Médiane |
Minimum |
Maximum |
Moyenne |
At Purchasing-Power-Parities
| Moyenne géométrique |
0,84 |
0,64 |
1,92 |
1,02 |
| Moyenne arithmétique |
0,90 |
0,71 |
2,06 |
1,07 |
| Nbre de DIN |
1 112 |
1 112 |
1 112 |
1 112 |
| Revenus nets (millions $) |
13 044,6 |
13 044,6 |
13 044,6 |
13 044,6 |
Source : CEPMB
Sous l’angle des résultats obtenus avec les taux de change du marché, le ratio de la médiane des prix pratiqués dans les pays de comparaison par rapport aux prix au Canada s’est maintenu à 0,98 en 2009 lorsque celui-ci a été calculé avec la moyenne géométrique et à 1,04 avec la moyenne arithmétique. Dans le rapport annuel 2008, ces valeurs étaient de 0,97 (moyenne géométrique) et 1,02 (moyenne arithmétique).
Le graphique 12 présente ce résultat dans une perspective historique. En 1987, les médianes des prix pratiqués dans les pays de comparaison étaient en moyenne de 19 % inférieures aux prix canadiens. Toutefois, en 1998, elles dépassaient les prix canadiens de 14 %. Depuis 2006, le ratio moyen de la médiane des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada s’est maintenu dans une fourchette de 3 % de la parité.
Les résultats obtenus avec les autres mesures multilatérales ne sont pas surprenants. Fait intéressant, la moyenne des prix pratiqués dans les pays de comparaison semble produire des ratios des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada plus élevés que les médianes des prix pratiqués dans les pays de comparaison. Cette situation s’explique par l’influence des prix pratiqués aux États-Unis où les prix sont beaucoup plus élevés que dans tous les autres pays. Les prix pratiqués aux États-Unis sont presque toujours pris en compte dans le calcul du prix moyen pratiqué dans les pays de comparaison, mais presque jamais dans la médiane des prix pratiqués dans les pays de comparaison.
Comme pour les comparaisons bilatérales, les différences entre les résultats obtenus avec les taux de change du marché et les résultats obtenus avec les parités des pouvoirs d’achat sont frappantes. Elles confirment l’idée que le Canada peut apparaître comme un pays où les prix des médicaments brevetés sont « moyens » en termes purement monétaires, mais où sa population doit sacrifier beaucoup plus de sa consommation d’autres produits et services pour acheter des produits médicamenteux brevetés que ne doivent le faire les résidants de la plupart des autres pays de comparaison. Avec la conversion des devises à l’aide de la parité des pouvoirs d’achat, le ratio moyen de la médiane des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada (moyenne géométrique) est de 0,84 pour 2009, soit beaucoup moins que la valeur de 0,98 obtenue avec les taux de change du marché.
Le graphique 13 présente avec encore plus de détails les ratios des prix des produits médicamenteux brevetés pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, ventilés selon la moyenne de la valeur des ventes présentée dans le tableau 14. Ce graphique ventile les ventes de médicaments brevetés effectuées en 2009 selon le ratio de la médiane des prix des produits médicamenteux brevetés pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada (ou, pour être plus précis, selon la fourchette dans laquelle s’inscrit le ratio)21. Ces résultats révèlent une dispersion importante des ratios de prix au niveau du produit. Alors que les produits dont les ratios du prix international médian par rapport au prix au Canada se situent entre 0,90 et 1,10 accaparaient 35,8 % des ventes, ceux dont les ratios se situent sous 0,90 en accaparaient 34,1 % et ceux dont les ratios dépassaient 1,10, 30,1 %.
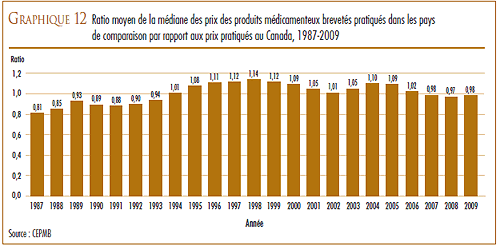
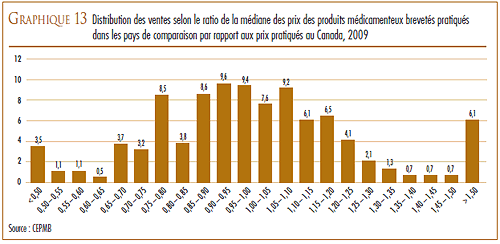
18 Le nombre de produits médicamenteux et la valeur des ventes varient selon le produit médicamenteux de comparaison étant donné qu’il n’est pas toujours possible de trouver pour chaque produit médicamenteux breveté vendu au Canada les prix auxquels le médicament est vendu dans les pays de comparaison. À cet égard, il convient ici de préciser que tous les ratios des prix moyens présentés dans les tableaux 13 et 14 couvrent au moins 81 % de la valeur des ventes au Canada en 2009. Les ratios déclarés des prix pratiqués aux États-Unis par rapport aux prix pratiqués au Canada couvrent environ 95 % des ventes de 2009.
19 Si RG représente le ratio moyen des prix calculé à l’aide de moyenne géométrique, RA correspond au ratio moyen des prix obtenu avec la moyenne arithmétique. Si p(i) représente le prix du médicament i pratiqué au Canada, pf(i) représente le prix de ce médicament à l’étranger (converti en dollars canadiens) et w(i) sa part de la valeur des ventes au Canada. Alors RG = Ð [pf(i)/p(i)]w(i) (où Ð représente le résultat de la multiplication de tous les médicaments brevetés), alors que RA = Ó w(i)[pf(i)/p(i)] (où Ó correspond à la somme de tous les produits médicamenteux brevetés).
Il peut ainsi être démontré que RG ne peut être supérieur à RA. Il est également possible de démontrer que l’écart entre RA et RG augmentera dans la même proportion que la variation des ratios des différents produits médicamenteux et que RG ne sera égal à RA que dans le cas où tous les ratios de prix ont la même valeur.
20 La différence entre ces deux statistiques est la suivante : la moyenne géométrique donne une réponse approximative à la question alors que la moyenne arithmétique y répond d’une façon précise. En conséquence, dans le rapport annuel 2010 et suivants, le CEPMB n’utilisera plus que la moyenne arithmétique.
21 Pour obtenir ces résultats, les prix dans les pays de comparaison ont été convertis en équivalents dollars canadiens à l’aide des taux de change du marché.
UTILISATION FAITE DES PRODUITS MÉDICAMENTEUX BREVETÉS
Les données sur les prix et sur la valeur des ventes utilisées pour calculer l’IPMB servent également à déterminer les tendances des quantités de médicaments brevetés vendus au Canada. Le CEPMB calcule à cette fin l’indice de volume des ventes de médicaments brevetés (IVVMB)22. Le graphique 14 présente pour les années 1988 à 2009 les taux moyens de croissance de l’utilisation des produits médicamenteux brevetés, mesurée à l’aide de l’IVVMB. Les résultats obtenus confirment que la croissance de l’utilisation faite des produits médicamenteux brevetés est le principal facteur d’augmentation de la valeur des ventes. Les taux de croissance de l’utilisation des dernières années talonnent en effet de près les taux de croissance de la valeur des ventes. Cette tendance s’est maintenue en 2009, le taux d’utilisation des produits médicamenteux brevetés ayant augmenté de 3,5 %. Considérant l’ampleur des effets (négatifs) du « retrait du marché » des produits médicamenteux et du prix minimal présentés dans le tableau 10, il n’est pas surprenant que le taux de croissance de l’utilisation faite des produits médicamenteux brevetés soit un peu plus élevé que le taux de croissance des ventes.
CROISSANCE DE L’UTILISATION FAITE DES PRODUITS MÉDICAMENTEUX BREVETÉS SELON LE GROUPE THÉRAPEUTIQUE PRINCIPAL
Le tableau 15 présente les taux moyens de croissance de l’utilisation faite des produits médicamenteux brevetés. Ces taux sont ventilés selon les groupes thérapeutiques principaux. Les résultats présentés dans ce tableau ont été obtenus en appliquant la méthodologie de l’IVVMB aux données du niveau 1 de la classification ATC. Comme dans le tableau 12, la dernière colonne donne un aperçu de la contribution des différents groupes thérapeutiques à la variation de l’IVVMB.
En 2009, les niveaux d’utilisation ont augmenté dans tous les groupes thérapeutiques sauf deux. Le groupe « Tube digestif et métabolisme » a connu une baisse marquée du niveau de l’utilisation. Le groupe « Agents néoplasiques et agents immunomodulateurs » a pour sa part enregistré la plus grande partie de l’augmentation de la croissance de l’utilisation. Quant aux produits médicamenteux agissant sur le système cardiovasculaire et sur le système respiratoire, ils ont aussi enregistré une forte croissance au niveau de leur utilisation, mais leur incidence est beaucoup moins grande qu’elle ne l’était dans les premières années de la présente décennie.
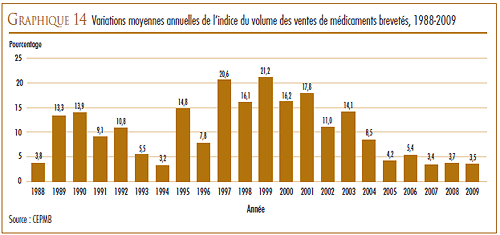
TABLEAU 15 Variation de l’indice du volume des ventes de produits médicamenteux brevetés selon le groupe thérapeutique principal, 2009
| Groupe thérapeutique principal |
Pourcentage des ventes de 2009 (%) |
Variation de l’IVVMB : 2008-2009 (%) |
Contribution à la variation de l’IVVMB (%) |
| A : Tube digestif et métabolisme |
8,2 |
-9,2 |
-0,8 |
| B : Sang et organes sanguinoformateurs |
6,5 |
-0,7 |
0,0 |
| C : Système cardiovasculaire |
24,5 |
2,4 |
0,6 |
| D : Produits dermatologiques |
0,8 |
-1,1 |
0,0 |
| G : Système génito-urinaire et hormones sexuelles |
4,1 |
7,3 |
0,3 |
| H : Préparations hormonales systémiques |
0,7 |
6,2 |
0,0 |
| J : Antiinfectieux généraux pour usage systémique P : Produits antiparasitaires** |
10,2 |
0,0 |
0,0 |
| L : Agents antinéoplasiques et agents immunomodulateurs |
17,9 |
15,5 |
2,8 |
| M : Système musculo-squelettique |
3,9 |
3,1 |
0,1 |
| N : Système nerveux |
12,3 |
0,0 |
0,0 |
| R : Système respiratoire |
8,0 |
6,4 |
0,5 |
| S : Organes sensoriels |
2,3 |
14,0 |
0,3 |
| V : Divers |
0,5 |
16,7 |
0,1 |
| Tous les groupes thérapeutiques |
100,0* |
3,5 |
3,5 |
* Le total de cette colonne peut ne pas correspondre exactement à 100,0 du fait que certains chiffres ont été arrondis. ** Pour des raisons de confidentialité, les données sur ces deux groupes ont été combinées.
Source : CEPMB
22 À l'instar de l'IPMB, l'IVVMB est calculé à l'aide de la formule de l'indice-chaîne de Laspeyres. Les ratios des volumes des ventes pour des périodes successives remplacent alors les ratios de prix de l'IPMB. Ici encore, la valeur cumulée de l'indice est obtenue sous forme d'une moyenne des ratios pondérée en fonction des recettes générées par les différents produits médicamenteux. Puisque l'IVVMB ne couvre que les produits médicamenteux brevetés, il ne représente pas les tendances de l'utilisation faite des produits médicamenteux sur l'ensemble du marché des produits médicamenteux.
VENTES DE PRODUITS MÉDICAMENTEUX AU CANADA PAR RAPPORT AUX VENTES DANS LES SEPT PAYS DE COMPARAISON
IMS Health23 fait régulièrement rapport des ventes médicaments dans différents pays. Le graphique 15 illustre la répartition de ces ventes entre le Canada et les sept pays que le CEPMB utilise dans ses examens de prix24. En ce qui concerne le Canada, les ventes de produits médicamenteux ont en 2009 représenté 2,5 % de l’ensemble des ventes sur les principaux marchés mondiaux, un taux légèrement moindre que celui du Royaume-Uni.
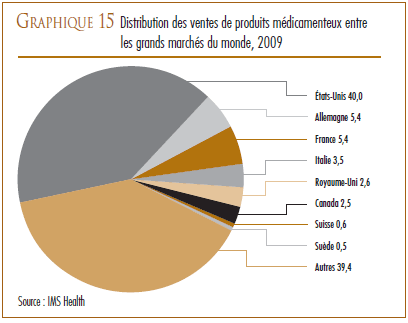
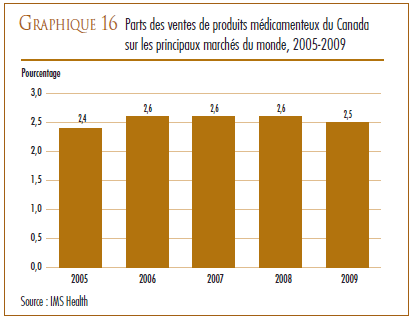
Le graphique 16 présente la part des ventes du Canada sur les principaux marchés canadiens pour les années 2005 à 2009. Pendant toutes ces années, la part des ventes s’est maintenue entre 2,4 % et 2,6 %.
Le graphique 17 compare la croissance des ventes de produits médicamenteux au Canada à celle des sept pays de comparaison, ensemble et séparément. Entre 2005 et 2009, les ventes au Canada de produits médicamenteux ont augmenté en moyenne de près de 6,9 par année. Pour la même période, les ventes dans les sept pays de comparaison ont augmenté en moyenne de 4,7 % par année.
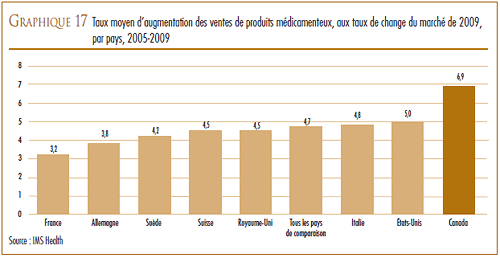
Le graphique 18 compare les taux de croissance annuelle des ventes de produits médicamenteux au Canada et dans l’ensemble des pays de comparaison. Entre 2006 et 2009, le taux de croissance des ventes de produits médicamenteux a été plus élevé au Canada que dans l’ensemble des pays de comparaison.
La comparaison des dépenses en produits médicamenteux peut aussi être faite à l’aide de la proportion du produit intérieur brut consacrée à l’achat de médicaments25. Le graphique 19 présente les dépenses en produits médicamenteux exprimées en pourcentage du produit intérieur brut (PIB) du Canada et des sept pays de compa - raison (données de 2007). Dans les sept pays de comparaison, les dépenses en produits médicamenteux ont accaparé entre 1,1 % et 1,9 % du PIB. Sur cette échelle, le Canada s’inscrit près de la limite supérieure.
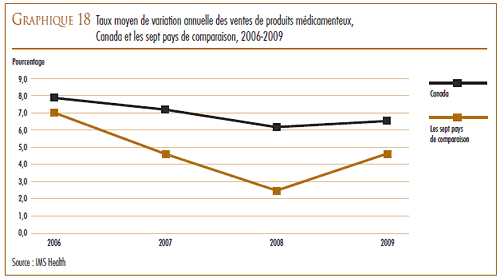
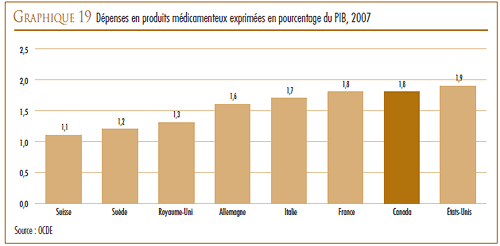
Au cours des dernières années, le pourcentage du PIB consacré aux dépenses en produits médicamenteux a augmenté dans la plupart des pays industrialisés. Le tableau 16 montre que les dépenses en produits médicamenteux ont, entre 2000 et 2007, augmenté plus rapidement que le PIB du Canada et des différents pays de comparaison, exception faite de la France et de l’Italie. En ce qui concerne les États-Unis, les résultats sont particulièrement frappants : les dépenses en produits médicamenteux y ont enregistré un taux de croissance presque deux fois plus élevé que le taux de croissance du produit intérieur. Au cours de la même période, les dépenses en produits médicamenteux au Canada ont augmenté d’un taux représentant plus ou moins une fois et demie le taux de croissance du PIB.
Le tableau 17 présente la valeur des ventes de produits médicamenteux au prix départ-usine au Canada, dans chaque pays de comparaison ainsi que dans l’ensemble des pays de comparaison26. À l’exception des produits pour le système cardiovasculaire (ces produits accaparent au Canada une part beaucoup plus importante de l’ensemble des ventes que dans les autres pays), ces résultats font ressortir un degré d’uniformité remarquable entre les différents pays.
TABLEAU 16 Dépenses en produits médicamenteux exprimées en pourcentage du PIB, 2007
| |
2007 Dépenses en produits médicamen- teux (% du PIB) |
2000 Dépenses en produits médicamen- teux (% du PIB) |
2000-2007 Croissance des dépenses en produits médicamenteux (%) |
2000-2007 Croissance du PIB (%) |
| Canada |
1,79 |
1,42 |
140,18 |
90,78 |
| France |
1,79 |
1,81 |
68,46 |
70,06 |
| Allemagne |
1,57 |
1,43 |
79,92 |
63,83 |
| Italie |
1,68 |
1,74 |
77,43 |
83,87 |
| Suède |
1,22 |
1,18 |
55,74 |
50,71 |
| Suisse |
1,11 |
1,11 |
42,79 |
42,48 |
| Royaume-Uni |
1,33 |
1,14 |
85,33 |
59,19 |
| États-Unis |
1,92 |
1,46 |
102,70 |
54,14 |
Source: OECD
TABLEAU 17 Ventes de produits médicamenteux selon le groupe thérapeutique principal au Canada et dans les pays de comparaison, 2009
| Groupe thérapeutique principal |
Canada |
Tous les pays de comparaison |
France |
Italie |
Allemagne |
Suède |
Suisse |
Royaume-Uni |
États-Unis |
| A : Tube digestif et métabolisme |
12,6 |
12,0 |
10,4 |
10,7 |
11,9 |
9,9 |
12,6 |
11,0 |
12,4 |
| B : Sang et organes sanguinoformateurs |
4,0 |
6,7 |
8,3 |
7,6 |
5,4 |
7,2 |
5,3 |
5,3 |
6,6 |
| C : Système cardiovasculaire |
21,6 |
12,5 |
15,0 |
16,8 |
11,6 |
9,0 |
14,3 |
12,5 |
11,9 |
| D : Produits dermatologiques |
2,8 |
2,3 |
2,3 |
2,2 |
2,5 |
2,3 |
3,5 |
3,1 |
2,1 |
| G : Système génito-urinaire et hormones sexuelles |
4,6 |
5,0 |
3,3 |
4,1 |
4,1 |
4,8 |
4,4 |
4,2 |
5,4 |
| H : Préparations hormonales systémiques |
1,0 |
1,6 |
1,7 |
1,7 |
2,0 |
2,4 |
1,4 |
1,9 |
1,4 |
| J : Antiinfectieux généraux pour usage systémique |
6,6 |
10,5 |
11,5 |
13,6 |
10,2 |
10,2 |
11,2 |
9,8 |
10,2 |
| P : Produits antiparasitaires** |
0,2 |
0,1 |
0,2 |
0,0 |
0,1 |
0,1 |
0,1 |
0,3 |
0,1 |
| L : Agents antinéoplasiques et agents immunomodulateurs |
10,0 |
12,3 |
14,6 |
13,1 |
14,8 |
14,5 |
12,9 |
10,7 |
11,6 |
| M : Système musculo-squelettique |
6,0 |
4,9 |
5,3 |
5,7 |
5,9 |
7,1 |
6,8 |
5,3 |
4,5 |
| N : Système nerveux |
18,1 |
18,7 |
13,9 |
11,6 |
16,2 |
18,6 |
16,1 |
19,1 |
20,3 |
| R : Système respiratoire |
6,9 |
7,8 |
6,4 |
6,1 |
7,2 |
8,4 |
6,6 |
9,9 |
8,1 |
| S : Organes sensoriels |
2,2 |
2,1 |
2,1 |
1,7 |
1,9 |
2,2 |
2,5 |
2,6 |
2,2 |
| V: Divers |
3,6 |
3,7 |
5,0 |
5,1 |
6,2 |
3,3 |
2,2 |
4,2 |
3,1 |
| Tous les groupes thérapeutiques |
100,0* |
100,0* |
100,0 |
100,0 |
100,0 |
100,0* |
100,0* |
100,0* |
100,0* |
* Le total de cette colonne peut ne pas correspondre exactement à 100,00 du fait que certains chiffres ont été arrondis.
Source : IMS Health
23 Dans les rapports annuels antérieurs, les résultats de la présente section se fondaient dans une large mesure sur les données du Retail Drug Monitor de IMS Health. Ce document présentait des estimés des achats directs (achats effectués directement auprès du fabricant) et des achats indirects des pharmacies (achats effectués auprès d’un grossiste) dans 13 pays industrialisés (Argentine, Australie, Brésil, Canada, France, Allemagne, Italie, Japon, Mexique, Nouvelle-Zélande, Espagne, Royaume-Uni et États-Unis). À compter du présent rapport, les résultats seront fondés sur les données de la base de données MIDAS de IMS Health. Par rapport au Retail Drug Monitor, les données de MIDAS couvrent les pharmacies et les hôpitaux ainsi qu’un plus large éventail de pays.
24 Les résultats présentés dans les graphiques 15 à 18 se fondent sur les estimés des ventes des produits médicamenteux de marque et génériques, brevetés et non brevetés que l’on trouve dans la base de données MIDAS de IMS Health. Ces estimés représentent la valeur des ventes convertie de la devise du pays en équivalents dollars canadiens aux taux de change du marché. Les fluctuations de ces taux peuvent exercer une influence importante sur la distribution entre les grands marchés du monde ainsi que sur les tendances observées au niveau de l’utilisation et des prix.
25 Comparisons made on this basis will reflect international differences in prices, overall utilization and patterns of therapeutic choice, as well as differences in national income.
26 Les données utilisées pour produire le tableau 17 couvrent les produits médicamenteux de marque et génériques tant brevetés que non brevetés. Par conséquent, les résultats présentés dans le tableau 17 ne peuvent être directement comparés à ceux présentés dans le tableau 11 qui, lui, couvre exclusivement les produits médicamenteux brevetés.
ANALYSE DES DÉPENSES EN RECHERCHE-DÉVELOPPEMENT
La Loi confère au CEPMB le mandat de faire le suivi des dépenses des brevetés en recherche-développement et de faire rapport des tendances observées (la Loi ne confère toutefois pas au CEPMB un droit de regard sur le montant des dépenses des brevetés dans la recherche-développement ni sur le type de recherche-développement). Le présent chapitre fournit les statistiques sur la situation actuelle des investissements dans la recherche-développement pharmaceutique au Canada.
SOURCES DES DONNÉES
La Loi oblige les brevetés à faire rapport au CEPMB des recettes qu’ils tirent des ventes de tous leurs produits médicamenteux pour usage humain et pour usage vétérinaire (y compris les recettes tirées des ventes de produits médicamenteux non brevetés et les recettes découlant d’ententes de production sous licence) ainsi que de leurs dépenses de R-D au Canada pour leurs différents produits médicamenteux (brevetés et non brevetés, pour usage humain et pour usage vétérinaire). Les résultats présentés ci-après ont été tirés des rapports semestriels que les brevetés ont soumis au Conseil sur le formulaire 3.
Le Règlement exige que le rapport sur les dépenses de R-D que le breveté doit soumettre au Conseil soit accompagné d’un document certifiant l’exactitude et la conformité des données fournies au Conseil. Le CEPMB ne vérifie pas systématiquement l’information qui lui est présentée, mais cherche plutôt les anomalies et les contradictions et, lorsqu’il y a lieu, demande aux brevetés de corriger leurs données ou de les étoffer. Pour garantir la juste interprétation des données, chaque breveté est invité à confirmer, avant la publication du rapport annuel, l’exactitude du ratio de ses dépenses de R-D par rapport aux recettes tirées des ventes calculé par le CEPMB.
Les sociétés pharmaceutiques qui n’ont fait aucune vente au Canada ne sont pas tenues de présenter un rapport sur leurs dépenses de R-D. Ainsi, alors que de nouveaux brevets sont attribués et que d’autres arrivent à échéance, la liste des sociétés pharmaceutiques ayant soumis un rapport sur leurs dépenses de R-D varie d’année en année. Pour 2009, 81 sociétés pharmaceutiques vendant des produits médicamenteux brevetés pour usage humain ou pour usage vétérinaire ont présenté des rapports sur leurs dépenses de recherche-développement. De ce nombre, 33 étaient membres de Rx&D (Les Compagnies de recherche pharmaceutique du Canada).
DÉFAUT DE SOUMETTRE SON RAPPORT SUR SES DÉPENSES DE R-D (FORMULAIRE 3)
Les brevetés sont tenus de soumettre leurs rapports complets dans les délais mentionnés dans le Règlement. Même si dans la plupart des cas les brevetés finissent par se conformer aux exigences du Règlement en matière de présentation de rapport, la présentation tardive des rapports constitue néanmoins un défaut de la part du breveté.
Pour la période de rapport 2009, le Conseil n’a pas été appelé à rendre des ordonnances pour défaut de soumettre son rapport sur ses recettes tirées des ventes et sur ses dépenses de R-D (formulaire 3).
RECETTES TIRÉES DES VENTES
Pour les fins du présent rapport, les recettes tirées des ventes s’entendent du produit brut des ventes de produits médicamenteux au Canada ainsi que des recettes découlant d’ententes de vente sous licence (par ex. redevances et droits de licences versés au breveté).
La valeur des recettes brutes tirées des ventes de produits médicamenteux au Canada déclarées par les brevetés a totalisé 17,1 milliards de dollars en 2009, ce qui représente une augmentation de 4,5 % par rapport à 2008 (tableau 18). Les recettes tirées des ventes déclarées par les brevetés membres de Rx&D ont totalisé 13,8 milliards de dollars pour la même période, soit 80,7 % de l’ensemble des recettes tirées des ventes. De ce montant, moins de 1 % des recettes découlent d’ententes de vente sous licence.
DÉPENSES EN R-D
En vertu de l’article 6 du Règlement, les brevetés ne doivent inclure dans leurs rapports que leurs dépenses de R-D qui auraient été admissibles au crédit d’impôt à l’investissement pour la recherche scientifique et le développement expérimental aux termes de la Loi de l’impôt sur le revenu, dans sa version du 1er décembre 1987. Ainsi, les dépenses de R-D peuvent inclure les dépenses courantes, les coûts d’immobilisation et l’amortissement autorisé. Les frais engagés pour les études de marché, la promotion des ventes, le contrôle de la qualité ou les essais systématiques de matériel, de dispositifs ou de produits ainsi que pour la collecte de données n’étant pas admissibles au crédit d’impôt à l’investissement, ils ne doivent pas figurer dans les rapports au CEPMB.
Le tableau 18 présente la valeur des dépenses de R-D déclarées par l’ensemble des brevetés pour la période de 1988 à 2009. En 2009, les dépenses des brevetés dans la R-D ont totalisé 1,2 milliard de dollars, soit 2,9 % de moins qu’en 2008. Les dépenses déclarées par les brevetés membres de Rx&D ont totalisé 1,1 milliard de dollars en 2009, ce qui représente un recul de 3,3 % par rapport à 2008. Les brevetés membres de Rx&D sont à la source de 89,1 % de toutes les dépenses de R-D déclarées par les brevetés. À titre de comparaison, les brevetés non membres de Rx&D ont déclaré des dépenses de R-D de 138,6 millions de dollars en 2009, soit 0,1 % de plus qu’en 2008.
TABLEAU 18 Dépenses de R-D déclarées par les brevetés et ratios des dépenses de R-D par rapport aux recettes tirées des ventes des brevetés, 1988-2009
| Année |
Nbre de brevetés |
Dépenses de R-D (millions $) |
Variation par rapport à l’année précédente (%) |
Recettes tirées des ventes (millions $) |
Variation par rapport à l’année précédente (%) |
Ratio des dépenses de R-D par rapport aux recettes tirées des ventes
Tous les brevetés (%) |
Ratio des dépenses de R-D par rapport aux recettes tirées des ventes
Brevetés membres de Rx&D |
| 2009 |
81 |
1 272,0 |
-2,9 |
17 051,9 |
4,5 |
7,5 |
8,2 |
| 2008 |
82 |
1 310,7 |
-1,1 |
16 316,7 |
2,0 |
8,1 |
8,9 |
| 2007 |
82 |
1 325,0 |
9,5 |
15 991,0 |
7,3 |
8,3 |
8,9 |
| 2006 |
72 |
1 210,0 |
-1,9 |
14 902,0 |
4,7 |
8,1 |
8,5 |
| 2005 |
80 |
1 234,3 |
5,5 |
14 231,3 |
0,5 |
8,7 |
8,8 |
| 2004 |
84 |
1 170,0 |
-2,0 |
14 168,3 |
4,0 |
8,3 |
8,5 |
| 2003 |
83 |
1 194,3 |
-0,4 |
13 631,1 |
12,8 |
8,8 |
9,1 |
| 2002 |
79 |
1 198,7 |
13,0 |
12 081,2 |
12,5 |
9,9 |
10,0 |
| 2001 |
74 |
1 060,1 |
12,6 |
10 732,1 |
15,3 |
9,9 |
10,6 |
| 2000 |
79 |
941,8 |
5,3 |
9 309,6 |
12,0 |
10,1 |
10,6 |
| 1999 |
78 |
894,6 |
12,0 |
8 315,5 |
19,2 |
10,8 |
11,3 |
| 1998 |
74 |
798,9 |
10,2 |
6 975,2 |
10,9 |
11,5 |
12,7 |
| 1997 |
75 |
725,1 |
9,0 |
6 288,4 |
7,4 |
11,5 |
12,9 |
| 1996 |
72 |
665,3 |
6,4 |
5 857,4 |
9,9 |
11,4 |
12,3 |
| 1995 |
71 |
625,5 |
11,5 |
5 330,2 |
7,5 |
11,7 |
12,5 |
| 1994 |
73 |
561,1 |
11,4 |
4 957,4 |
4,4 |
11,3 |
11,6 |
| 1993 |
70 |
503,5 |
22,1 |
4 747,6 |
14,0 |
10,6 |
10,7 |
| 1992 |
71 |
412,4 |
9,6 |
4 164,4 |
6,9 |
9,9 |
9,8 |
| 1991 |
65 |
376,4 |
23,2 |
3 894,8 |
18,1 |
9,7 |
9,6 |
| 1990 |
65 |
305,5 |
24,8 |
3 298,8 |
11,0 |
9,3 |
9,2 |
| 1989 |
66 |
244,8 |
47,4 |
2 973,0 |
9,4 |
8,2 |
8,1 |
| 1988 |
66 |
165,7 |
- |
2 718,0 |
- |
6,1 |
6,5 |
Source : CEPMB
RATIO DES DÉPENSES DE R-D PAR RAPPORT AUX RECETTES TIRÉES DES VENTES
Le tableau 18 présente également les ratios des dépenses de R-D par rapport aux recettes tirées des ventes. En 1987, en contrepartie de l’adoption des modifications apportées à la Loi, Rx&D s’était engagé à augmenter graduellement ses dépenses annuelles de recherche-développement pour qu’elles totalisent en 1996 au moins 10 % des recettes tirées des ventes.27
Le ratio de 2009 des dépenses de R-D par rapport aux recettes tirées des ventes de tous les brevetés est de 7,5 % alors qu’il était de 8,1 % en 2008. Le ratio de 2009 est le plus bas ratio obtenu depuis 1989 et coïncide avec la neuvième fois en autant d’années que le ratio des dépenses de R-D par rapport aux recettes tirées des ventes se situe sous la barre des 10 %. Quant au ratio des brevetés membres de Rx&D, il est de 8,2 % pour 2009, une baisse par rapport à 2008 où il se situait à 8,9 %28. Ce ratio est le plus bas ratio enregistré depuis 1990 et coïncide avec la septième année consécutive où les brevetés membres de Rx&D n’atteignent pas 10 %. Dans l’ensemble, les ratios des dépenses de R-D par rapport aux recettes tirées des ventes de tous les brevetés et des brevetés membre de Rx&D accusent une baisse depuis le milieu des années 1990.
Le tableau 24 à l’Annexe 4 présente les ratios des dépenses de R-D par rapport aux recettes tirées des ventes. Des 81 brevetés ayant soumis des rapports sur leurs dépenses de R-D au CEPMB en 2009, 63 ont présenté un ratio de R-D par rapport aux recettes tirées des ventes de moins de 10 %. Les recettes de ces derniers représentent 71 % des recettes tirées des ventes en 2009.

DÉPENSES COURANTES DE R-D SELON LE TYPE DE RECHERCHE
Le tableau 19 et le graphique 21 (ainsi que le graphique 24 dans l’Annexe 4) ventilent les dépenses courantes de R-D29 engagées en 2009 selon le type de recherche, à savoir la recherche fondamentale, la recherche appliquée et autres types de recherche admissible30. Pour 2009, les brevetés ont fait état de dépenses de recherche fondamentale totalisant 237,1 millions de dollars ou 19,4 % du total des dépenses courantes de R-D, soit une augmentation de 18,4 % par rapport aux dépenses de 2008. Les brevetés ont déclaré des dépenses de recherche appliquée totalisant 685,3 millions de dollars ou, encore, 56,2 % des dépenses courantes de R-D. Les essais cliniques ont accaparé 76,8 % des dépenses de recherche appliquée.
DÉPENSES COURANTES DE R-D SELON LE MILIEU DE RECHERCHE ET LA PROVENANCE DES FONDS
Les brevetés peuvent inclure dans leurs dépenses de R-D la recherche qu’ils effectuent eux-mêmes à l’interne ainsi que la recherche qu’ils font faire à l’externe, notamment par des universités, des hôpitaux et d’autres sociétés pharmaceutiques. Le tableau 20 révèle que, en 2009, 51,6 % des dépenses de R-D ont été effectuées à l’interne. En 2008, cette proportion était de 49,2 %. La proportion de la R-D effectuée à l’externe pour le compte des brevetés a représenté 19,9 % de l’ensemble des dépenses courantes de R-D. Quant à la recherche effectuée par les universités et par les hôpitaux, sa valeur a représenté 15,4 % des dépenses courantes de R-D.
TABLEAU 19 Dépenses courantes de R-D selon le type de recherche, 2009 et 2008
| Type de recherche |
2009
millions $ |
2009
%
|
2008
millions $ |
2008
% |
Variation annuelle des dépenses (%) |
| Recherche fondamentale |
237,1 |
19,4 |
200,2 |
15,9 |
18,4 |
| Chimique |
125,6 |
10,3 |
126,4 |
10,0 |
-0,6 |
| Biologique |
111,5 |
9,1 |
73,8 |
5,9 |
51,1 |
| Recherche appliquée |
685,3 |
56,2 |
723,2 |
57,3 |
-5,2 |
| Processus de fabrication |
86,9 |
7,1 |
90,5 |
7,2 |
-4,0 |
| Essais précliniques I |
7,7 |
0,6 |
30,7 |
2,4 |
-74,9 |
| Essais précliniques II |
64,2 |
5,3 |
62,1 |
4,9 |
3,4 |
| Essais cliniques Phase I |
45,0 |
3,7 |
53,1 |
4,2 |
-15,3 |
| Essais cliniques Phase II |
116,4 |
9,6 |
125,0 |
9,9 |
-6,9 |
| Essais cliniques Phase III |
365,1 |
29,9 |
361,8 |
28,7 |
0,9 |
| Autre R-D admissible |
296,8 |
24,3 |
337,9 |
26,9 |
-12,2 |
| Total |
1,219,2 |
100,0* |
1,261,3 |
100,0* |
-3,3 |
* Le total de la colonne peut ne pas totaliser exactement 100,0 du fait que certains chiffres ont été arrondis.
Source : CEPMB
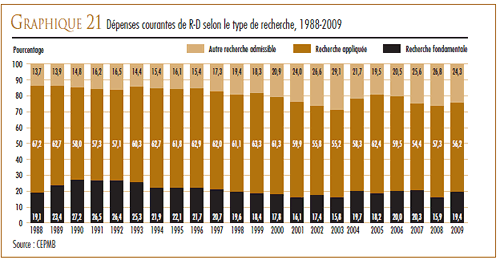
Le tableau 21 présente des renseignements sur la provenance des fonds que les brevetés ont investis pour financer leurs activités de R-D. En 2009, les brevetés ont financé à même leurs propres fonds la majeure partie de leur R-D (89,6 % des dépenses courantes de R-D). Les fonds provenant du gouvernement n’ont servi à financer que 2,6 % de l’ensemble des dépenses courantes de R-D.
DÉPENSES COURANTES DE R-D SELON LA RÉGION GÉOGRAPHIQUE
Le tableau 22 (ainsi que le tableau 25 dans l’Annexe 4) ventile les dépenses courantes de R-D selon la région géographique dans laquelle elles ont été engagées. Cette année encore, les dépenses ont été surtout engagées en Ontario et au Québec qui ont accaparé 87,4 % de la valeur totale des dépenses courantes de R-D au Canada. La valeur des dépenses de R-D a augmenté d’un taux annuel de 19,7 % dans l’Ouest du pays, mais elle a reculé de 4,6 % en Ontario et de 6,5 % au Québec.
TABLEAU 20 Dépenses courantes de R-D selon le milieu de recherche, 2009 et 2008
| Milieu de recherche |
2009
millions $
|
2009
% |
2008
millions $ |
2008
% |
Variation annuelle des dépenses(%) |
| À l’interne |
| Brevetés |
628,8 |
51,6 |
620,5 |
49,2 |
1,3 |
| À l’externe |
| Universités et hôpitaux |
187,9 |
15,4 |
162,1 |
12,9 |
15,8 |
| Autres sociétés |
242,6 |
19,9 |
282,6 |
22,4 |
-14,1 |
| Autres |
159,9 |
13,1 |
196,1 |
15,5 |
-18,4 |
| Total |
1 219,2 |
100,0* |
1 261,3 |
100,0* |
-3,3 |
* Le total de la colonne peut ne pas totaliser exactement 100,0 du fait que certains chiffres ont été arrondis.
Source : CEPMB
TABLEAU 21 Dépenses courantes de R-D selon la provenance des fonds, 2009 et 2008
| Provenance des fonds |
2009
millions $
|
2009
% |
2008
millions $ |
2008
% |
Variation annuelle des dépenses(%) |
| Brevetés |
1 139.6 |
89,6 |
1 182,7 |
90,2 |
-3,6 |
| Gouvernements fédéral/provinciaux |
33,8 |
2,6 |
36,3 |
2,8 |
-6,9 |
| Autres |
98,6 |
7,7 |
91,7 |
7,0 |
7,5 |
| Total |
1 272,0 |
100,0* |
1 310,7 |
100,0* |
-2,9 |
* Le total de la colonne peut ne pas totaliser exactement 100,0 du fait que certains chiffres ont été arrondis.
Source : CEPMB
TABLEAU 22 Dépenses courantes de R-D selon la région géographique, 2009 et 2008
| Région géographique |
2009
millions $
|
2009
% |
2008
millions $ |
2008
% |
Variation annuelle des dépenses (%) |
| Provinces de l’Atlantique |
19,6 |
1,6 |
21,3 |
1,7 |
-8,3 |
| Québec |
498,0 |
40,8 |
532,5 |
42,2 |
-6,5 |
| Ontario |
568,5 |
46,6 |
596,1 |
47,3 |
-4,6 |
| Provinces de l’Ouest |
133,1 |
10,9 |
111,2 |
8,8 |
19,7 |
| Territoires |
0,0 |
0,0 |
0,2 |
0,0 |
-84,1 |
| Total |
1 219,2 |
100,0* |
1 261,3 |
100,0* |
-3,3 |
* Le total de la colonne peut ne pas totaliser exactement 100,0 du fait que certains chiffres ont été arrondis.
Source : CEPMB
LE CONTEXTE MONDIAL
Le graphique 22 compare pour les années 2000 et 2007 les ratios des dépenses de R-D par rapport aux recettes tirées des ventes du Canada aux mêmes ratios des sept pays de comparaison31. Comme nous l’observons dans le graphique 22, le ratio du Canada était de 10,1 % en 2000. Cette année-là, seule l’Italie présentait un ratio plus bas (6,2 %). La Suisse présentait le ratio d’investissements dans la R-D par rapport aux recettes tirées des ventes le plus élevé (102,5 %). La même tendance a été observée pour 2007. En 2007, l’Italie présentait le ratio le moins élevé (7,1 %), suivi du Canada (8,3 %). Le ratio obtenu avec l’ensemble des dépenses de R-D et des ventes de tous les pays de comparaison était de 20,9 % cette même année, soit deux fois et demie celui du Canada.
Il y a lieu de comparer les ratios des dépenses de R-D par rapport aux recettes tirées des ventes présentés dans le graphique 22 avec les ratios des prix moyens dans les pays de comparaison par rapport aux prix au Canada présentés dans le graphique 11 (page 29). Cette comparaison ne dégage aucune corrélation entre le ratio des dépenses de R-D par rapport aux recettes tirées des ventes d’un pays et ses politiques régissant les prix auxquels les produits médicamenteux brevetés peuvent être vendus. De fait, plusieurs pays de comparaison ont des ratios des dépenses de R-D par rapport aux recettes tirées des ventes beaucoup plus élevés que ceux du Canada même si les prix des produits médicamenteux brevetés ne sont généralement pas beaucoup plus élevés (ou même moins élevés) dans ces pays qu’au Canada. La France constitue un point de comparaison particulièrement intéressant. Son ratio des dépenses de R-D par rapport aux recettes tirées des ventes est deux fois plus élevé que celui du Canada alors que les prix de vente y sont inférieurs d’au moins 10 % aux prix de vente au Canada et ce, pour les mêmes produits médicamenteux.
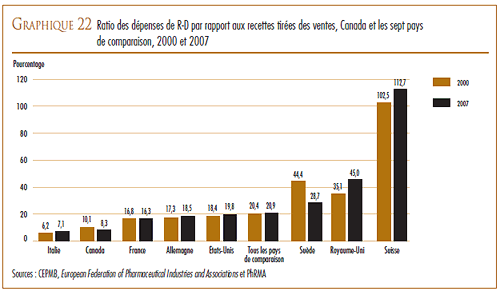
27 Selon le Résumé de l’étude d’impact de la réglementation (RÉIA) du Règlement sur les médicaments brevetés, 1988 publié dans la Partie II de la Gazette du Canada, vol. 122, no 20 – SOR/DORS/88-474.
26 Dans le tableau 18, les ratios des dépenses de R-D par rapport aux ventes tiennent compte des dépenses de recherche financées par le gouvernement au moyen de subventions. Si on exclut le financement accordé par le gouvernement, le ratio pour tous les brevetés est de 7,3 % et celui pour les brevetés membres de Rx&D est de 8,0 %.
25 Les dépenses courantes de R-D comprennent les dépenses autres qu’en capital directement associées à la recherche, dont (a) les salaires, (b) le matériel direct, (c) les honoraires des entrepreneurs et des sous-traitants, (d) d’autres coûts directs de production tels que les frais généraux, (e) les paiements aux institutions désignées, (f) les paiements aux organismes subventionnaires et (g) les paiements à d’autres organismes. Ces éléments sont décrits plus en détail dans le Formulaire 3 – Recettes et dépenses en recherche et développement, affiché dans le site Web du CEPMB sous « Formulaires réglementaires ». Les dépenses courantes de R-D représentent 96 % de l’ensemble des dépenses de R-D de 2009. Les coûts en immobilisations représentent 2,2 % des dépenses courantes de R-D et les frais d’amortissement admissibles, 1,8 %.
30 La « recherche fondamentale » désigne les travaux qui contribuent à faire avancer la connaissance scientifique et qui sont entrepris sans aucune application scientifique en vue. La « recherche appliquée » désigne les travaux qui contribuent à faire avancer la connaissance scientifique et qui sont entrepris avec une application pratique en vue. Elle peut viser à créer de nouveaux produits ou procédés, à améliorer ceux qui existent à l’aide de procédés de fabrication ou, encore, d’études précliniques ou cliniques. Enfin, l’expression « Autre R-D admissibles » désigne les présentations sur la réglementation des médicaments, les études de biodisponibilité ainsi que les essais cliniques de phase IV.
31 Dans le graphique 22, les ventes sont celles effectuées exclusivement au pays. Elles ne comprennent pas les ventes à l’exportation.
SYSTÈME NATIONAL D’INFORMATION SUR L’UTILISATION DES MÉDICAMENTS PRESCRITS
Le Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP) effectue des analyses critiques des tendances des prix des produits médicamenteux d’ordonnance, de l’utilisation faite de ces produits et des coûts en produits médicamenteux au Canada. Les résultats de ces analyses éclairent le processus de décision des régimes d’assurance-médicaments fédéraux, provinciaux et territoriaux participants. Le mandat du SNIUMP comporte les deux volets suivants :
- élaboration d’une base de données sur les demandes de remboursement soumises aux différents régimes d’assurance-médicaments
- préparation de rapports présentant les conclusions des analyses effectuées à l’aide des renseignements de la base de données.
L’Institut canadien d’information sur la santé (ICIS) s’occupe du premier volet de ce mandat et le CEPMB, du second volet (le ministre de la Santé ayant confié cette responsabilité au CEPMB en vertu de l’article 90 de la Loi sur les brevets).
Un comité directeur, constitué de représentants des régimes publics d’assurancemédicaments de la Colombie-Britannique, de l’Alberta, de la Saskatchewan, du Manitoba, de l’Ontario, du Nouveau-Brunswick, de la Nouvelle-Écosse, de l’Île-du- Prince-Édouard, Terre-Neuve-et-Labrador, du Yukon et de Santé Canada, conseille le CEPMB sur son programme de recherche et lui suggère des sujets d’étude. En 2009, le Comité directeur du SNIUMP a tenu des téléconférences trimestrielles ainsi que deux réunions à Ottawa.
En 2009, le CEPMB a poursuivi ses analyses sur les dépenses en honoraires des pharmaciens, sur les prix des produits médicamenteux génériques ainsi que sur l’incidence de l’introduction sur le marché des versions génériques des produits médicamenteux de marque sur l’utilisation faite des produits médicamenteux. Suite à une discussion sur les sujets d’analyses prioritaires tenue au cours de la réunion de mai du Comité directeur du SNIUMP, les nouveaux sujets d’analyse suivants se sont ajoutés : économies pouvant découler de l’arrivée à échéance des brevets de certains produits médicamenteux vedettes, politiques sur les frais accessoires chargés par les grossistes et utilisation des bâtonnets de diagnostic par les personnes atteintes du diabète.
Dans un effort pour communiquer les résultats des analyses effectuées par le SNIUMP et recruter des chercheurs du secteur privé, le CEPMB a organisé une réunion conjointe du Comité directeur du SNIUMP et du Pharmaceutical Policy Research Collaboration (PPRC), un réseau de chercheurs associés à des universités qui est financé au moyen de contributions des Instituts de recherche en santé du Canada. Ce réseau s’intéresse tout particulièrement aux questions touchant les produits médicamenteux. La réunion a constitué pour les chercheurs et pour les décideurs une occasion toute choisie pour échanger des points de vue et de l’information et pour identifier leurs priorités communes de sujets de recherches futures.
COMMUNICATIONS
PROGRAMME DES COMMUNICATIONS
Le programme des communications s’occupe de la planification et de la gestion des communications du CEPMB avec les intervenants et le grand public. Il assure également la visibilité de l’organisation. Le programme cherche tout particulièrement à adapter le CEPMB aux nouvelles exigences de l’environnement dans lequel il évolue.
Sur le plan de l’élaboration et de la gestion des communications à l’externe, le programme s’occupe des relations avec les médias et rapporte les résultats des procédures quasi judiciaires du Conseil.
PUBLICATIONS
À l’aide de ses différentes publications, le CEPMB tient ses intervenants bien informés. Certaines publications, dont le Rapport annuel et La Nouvelle, sont publiées à intervalles réguliers alors que d’autres sont publiées spécifiquement aux fins d’un programme ou pour les besoins de l’organisation.
Toutes les publications du CEPMB, y compris les décisions que rend le Conseil en vertu d’une audience, sont affichées dans son site Web.

GLOSSAIRE
Le glossaire qui suit a été préparé dans le but de faciliter votre compréhension. Vous trouverez de plus amples explications et définitions dans les documents suivants : Loi sur les brevets, Règlement sur les médicaments brevetés, Compendium des politiques, des Lignes directrices, et des procédures et Règlement sur les aliments et drogues ou, encore, en communiquant directement avec le CEPMB.
ATC : Système de classification anatomique, thérapeutique, chimique (ATC) conçu et tenu à jour par le Centre collaborateur de l’OMS pour la méthodologie sur l’établissement des statistiques concernant les produits médicamenteux de l’Organisation mondiale de la santé (OMS). Ce système distingue les médicaments selon leur site d’action et leurs caractéristiques thérapeutiques et chimiques. Le CEPMB utilise ce système pour sélectionner les médicaments qui seront utilisés dans les comparaisons des prix.
Avis de conformité : Avis donné par la Direction générale des produits de santé et des aliments de Santé Canada en vertu de l’article C.08.004 du Règlement sur les aliments et drogues. Cet avis confirme que le produit médicamenteux respecte les normes prescrites par Santé Canada pour une administration à des humains ou à des animaux, selon le cas, et que sa vente est autorisée au Canada.
Brevet : Instrument émis par le Commissaire aux brevets sous forme de lettres patentes. Le brevet confère à son titulaire un monopole d’une durée limitée pour les allégations formulées. Le brevet confère également à son titulaire et à ses représentants légaux le droit exclusif de fabriquer, de construire, d’exploiter ou de vendre son invention.
Brevet en instance : Demande pour un brevet qui n’a pas encore été attribué.
Breveté : Aux termes du paragraphe 79(1) de la Loi sur les brevets, le mot « breveté » désigne « la personne ayant droit aux retombées d’un brevet pour une invention liée à un médicament, ainsi que quiconque était titulaire d’un brevet pour une telle invention ou qui exerce ou a exercé les droits d’un titulaire dans un cadre autre qu’une licence prorogée en vertu du paragraphe 11(1) de la Loi de 1992 modifiant la Loi sur les brevets ».
Certificat de décision préalable : Certificat révocable émis à la demande du breveté en vertu du paragraphe 98(4) de la Loi sur les brevets lorsque le Conseil estime que le prix pratiqué ou proposé du produit médicamenteux ne dépasse pas le prix moyen maximal potentiel qu’autorisent ses Lignes directrices.
Cession de brevet : Avis donné par le breveté au Commissaire aux brevets l’informant qu’il renonce irrévocablement à ses droits de propriété à l’égard du brevet en cause et qu’il les cède au domaine public. Nota : Depuis le 30 janvier 1995, le Conseil ne reconnaît pas la cession d’un brevet lorsque le breveté utilise cette mesure pour se soustraire à sa compétence en matière d’examen du prix.
Défaut de présenter ses rapports : Défaut partiel ou complet d’un breveté de présenter les rapports qu’il est tenu de présenter au CEPMB en vertu de la Loi sur les brevets et du Règlement sur les médicaments brevetés.
Dépenses de recherche et développement : Aux termes du Règlement sur les médicaments brevetés, et plus particulièrement de ses articles 5 et 6, la recherchedéveloppement s’entend des activités qui auraient été considérées admissibles au crédit d’impôt à l’investissement pour la recherche scientifique et le développement expérimental en vertu de la Loi de l’impôt sur le revenu dans sa version du 1er décembre 1987.
Dépenses courantes de recherchedéveloppement : Désigne les dépenses autres qu’en capital directement liées à la recherche, dont : (a) salaires, (b) matériel direct, (c) entrepreneurs et sous-traitants, (d) autres coûts directs tels que les frais généraux de production, (e) paiements aux institutions désignées, (f) paiements aux organismes subventionnaires et (g) paiements aux autres organismes. Ces éléments sont décrits plus amplement dans le formulaire 3 présenté dans le Guide du breveté que vous trouverez dans notre site Web sous « Formulaires réglementaires ».
Engagement de conformité volontaire : Engagement écrit pris par le breveté de baisser le prix de son produits médicamenteux pour le rendre conforme aux Lignes directrices du Conseil. Le président du Conseil peut, en lieu d’un avis d’audience, approuver un engagement de conformité volontaire s’il sert les meilleurs intérêts du grand public. La politique du Conseil sur la conformité et l’application autorise le breveté à soumettre un engagement de conformité volontaire même si un avis d’audience a été émis. Toutefois, l’engagement soumis à ce point doit être approuvé par le panel d’audience et non seulement par le président du Conseil. Le Conseil publie tous les engagements approuvés par le président ou par un panel d’audience.
Indice des prix des médicaments brevetés (IPMB) : Indice établi par le CEPMB pour mesurer la variation annuelle des prix de transaction des médicaments brevetés vendus au Canada. Cet indice est établi à partir des données sur les prix et sur les ventes déclarées par les brevetés.
Licence volontaire : Engagement contractuel entre un breveté et un titulaire de licence permettant à ce dernier de bénéficier des retombées d’un brevet ou d’exercer des droits à l’égard de celui-ci moyennant une contrepartie financière (comme, par ex., redevances sous forme de pourcentage des recettes tirées des ventes).
Médicament : Toute substance ou tout mélange de substances produites biologiquement, chimiquement ou autrement qui est appliqué ou administré in vivo pour faciliter le diagnostic, le traitement, l’atténuation ou la prévention d’une maladie, de symptômes, de troubles ou d’états physiques anormaux ou, encore, pour modifier des fonctions organiques chez les humains ou chez les animaux. Cette définition comprend les vaccins, les préparations topiques, les anesthésiques et les produits diagnostics in vivo quel que soit le mode d’administration (par ex. préparations transdermiques, gélules, solutions injectables, solutions pour inhalation, etc.) Cette définition exclut les appareils médicaux, les produits diagnostiques in vitro et les désinfectants qui ne sont pas utilisés in vivo.
Numéro d’identification de drogue (DIN) : Numéro d’identification que la Direction générale de la protection de la santé de Santé Canada attribue à chaque produit médicamenteux vendu sous ordonnance ou en vente libre et commercialisé en vertu du Règlement sur les aliments et drogues. Le DIN est assigné en tenant compte des éléments suivants : le fabricant du produit, le ou les ingrédients actifs, la concentration de ou des ingrédients actifs, la forme posologique, le nom de marque du produit et son mode d’administration.
Produit générique : Produit médicamenteux contenant le même ingrédient actif, la même concentration et la même forme posologique que son équivalent de marque.
Produit médicamenteux : Présentation d’un médicament qui se distingue par sa forme pharmaceutique et la concentration de son ingrédient actif.
Programme d’accès spécial : Programme en vertu duquel Santé Canada permet à des praticiens d’avoir accès à des produits médicamenteux n’ayant pas encore reçu l’avis de conformité et qui ne seraient autrement pas disponibles sur le marché canadien.
Recherche et développement (R-D) : Recherche fondamentale ou appliquée visant à créer de nouveaux matériaux, dispositifs, produits ou procédés ou à améliorer ceux qui existent (par ex. procédés de fabrication).
Recherche et développement – recherche appliquée : Travaux qui sont entrepris avec une application pratique en vue. Ils peuvent viser à créer de nouveaux produits ou procédés, à améliorer ceux qui existent à l’aide de procédés de fabrication ou, encore, d’études précliniques et cliniques.
Recherche et développement – recherche fondamentale : Travaux qui contribuent à faire avancer la connaissance scientifique et qui sont entrepris sans aucune application pratique en vue.
Recherche-développement – autres R-D admissibles : Comprend les dépenses de recherche-développement qui ne correspondent à aucune des catégories de R-D susmentionnées. Elle comprend les présentations sur la réglementation des produits médicamenteux, les études de biodisponibilité ainsi que les essais cliniques de Phase IV.
Substance active : Substance chimique ou biologique responsable de l’effet pharmacologique d’un produit médicamenteux.
ANNEXE 1
CRITÈRES JUSTIFIANT LA TENUE D’UNE ENQUÊTE
Un prix est considéré conforme aux Lignes directrices dans la mesure où aucun critère ne justifie une enquête. Les critères correspondent aux normes qu’applique le Conseil pour utiliser de la façon la plus efficiente possible les ressources dont il dispose pour les enquêtes. L’existence de ces critères ne sous-entend pas que le Conseil tolère les écarts à ses Lignes directrices. Le Conseil estime que ses critères permettent de reconnaître et de soumettre à une enquête tous les cas importants de prix non conformes à ses Lignes directrices. Le Conseil s’attend à ce que les prix de tous les médicaments brevetés soient conformes à ses Lignes directrices et tout élément de preuve démontrant que le prix d’un produit médicamenteux se maintient au-delà de ce que permettent ses Lignes directrices, ne serait-ce que d’une petite fraction, peut justifier la tenue d’une enquête.
Le personnel du Conseil engagera une enquête sur le prix d’un produit médicamenteux lorsqu’il a observé une des situations suivantes :
NOUVEAUX PRODUITS MÉDICAMENTEUX
- le prix de lancement dépasse d’au moins 5 % le prix maximum non excessif (MNE)
- les recettes excessives tirées de la vente du produit médicamenteux à un prix excessif au cours de la période de lancement totalisent 25 000 $ ou plus
- la réception de plaintes fondées.
PRODUITS MÉDICAMENTEUX EXISTANTS
- le prix dépasse d’au moins 5 % le prix MNE et les recettes excessives tirées de la vente du produit médicamenteux à un prix excessif au cours de toute la durée du brevet à compter du 1er janvier 1992 sont égales ou supérieures à 25 000 $
- les recettes excessives encaissées tout au cours de la durée du brevet à compter du 1er janvier 1992 sont égales ou supérieures à 50 000 $
- la réception de plaintes fondées.
Le Compendium des politiques, des Lignes directrices et des procédures fournit de plus amples renseignements sur les critères qui justifient la tenue d’une enquête. Le Compendium est affiché dans le site Web du CEPMB sous la rubrique « Loi, Règlement et Lignes directrices ».
ANNEXE 2
PRODUITS MÉDICAMENTEUX BREVETÉS LANCÉS SUR LE MARCHÉ CANADIEN EN 2009
| Nom de marque |
Breveté |
DIN |
NAS1/PBA2 |
ATC3 |
Statut |
Catégorie |
| Abilify - 2 mg/comprimé |
Bristol-Myers Squibb Canada Co. |
02322374 |
|
N |
Conforme aux Lignes directrices |
1 |
| Abilify - 5 mg/comprimé |
Bristol-Myers Squibb Canada Co. |
02322382 |
|
N |
Conforme aux Lignes directrices |
1 |
| Abilify - 10 mg/comprimé |
Bristol-Myers Squibb Canada Co. |
02322390 |
|
N |
Conforme aux Lignes directrices |
1 |
| Abilify - 15 mg/comprimé |
Bristol-Myers Squibb Canada Co. |
02322404 |
NAS/PBA |
N |
Sous enquête |
3 |
| Abilify - 20 mg/comprimé |
Bristol-Myers Squibb Canada Co. |
02322412 |
|
N |
Conforme aux Lignes directrices |
1 |
| Abilify - 30 mg/comprimé |
Bristol-Myers Squibb Canada Co. |
02322455 |
PBA |
N |
Conforme aux Lignes directrices |
1 |
| Actonel - 150 mg/comprimé |
Procter & Gamble Pharmaceuticals Canada Inc. |
02316838 |
|
M |
Conforme aux Lignes directrices |
1 |
| Alimta - 100 mg/fiole |
Eli Lilly Canada Inc. |
02306433 |
|
L |
Conforme aux Lignes directrices |
1 |
| Alrex - 2 mg/ml |
Bausch & Lomb Canada Inc. |
02320924 |
NAS |
S |
Sous examen |
3 |
| Apidra - 100 unit/ml |
sanofi-aventis Canada Inc. |
02279460 |
PBA |
A |
Conforme aux Lignes directrices |
1 |
| Apidra - 100 unit/ml |
sanofi-aventis Canada Inc. |
02279479 |
|
A |
Sous examen |
1 |
| Apidra Solostar - 100 unit/ml |
sanofi-aventis Canada Inc. |
02294346 |
NAS/PBA |
A |
Conforme aux Lignes directrices |
3 |
| Atacand Plus 32/12.5 - 44.5 mg/comprimé |
AstraZeneca Canada Inc. |
02332922 |
|
C |
Sous examen |
1 |
| Atacand Plus 32/25 - 57 mg/comprimé |
AstraZeneca Canada Inc. |
02332957 |
|
C |
Sous examen |
1 |
| Azarga 1/0.5 - 1.5 mg/ml |
Alcon Canada Inc. |
02331624 |
|
S |
Sous examen |
3 |
| Cayston - 75 mg/fiole |
Gilead Sciences Inc. |
02329840 |
|
J |
Sous examen |
3 |
| Cimzia - 200 mg/ml |
UCB Canada Inc. |
02331675 |
NAS |
L |
Sous examen |
3 |
| Coversyl Plus HD 8/2.5 - 10.5 mg/comprimé |
Servier Canada Inc. |
02321653 |
|
C |
Conforme aux Lignes directrices |
1 |
| DDVAP Melt - 240 mcg/comprimé |
Ferring Inc. |
02285010 |
|
H |
Conforme aux Lignes directrices |
1 |
| Doribax - 500 mg/fiole |
Janssen-Ortho Inc. |
02332906 |
NAS |
J |
Sous examen |
3 |
| Emend IV - 115 mg/fiole |
Merck Frosst Canada Ltd. |
02324679 |
NAS |
A |
Conforme aux Lignes directrices |
3 |
| Firmagon - 80 mg/fiole |
Ferring Inc. |
02337029 |
NAS |
L |
Conforme aux Lignes directrices |
3 |
| Firmagon - 120 mg/fiole |
Ferring Inc. |
02337037 |
NAS |
L |
Conforme aux Lignes directrices |
3 |
| Infanrix-Hexa |
GlaxoSmithKline Inc. |
02253852 |
|
J |
Conforme aux Lignes directrices |
3 |
| Janumet 50/500 - 550 mg/comprimé |
Merck Frosst Canada Ltd. |
02333856 |
|
A |
Sous examen |
3 |
| Janumet 50/850 - 900 mg/comprimé |
Merck Frosst Canada Ltd. |
02333864 |
|
A |
Sous examen |
3 |
| Janumet 50/1000 - 1050 mg/comprimé |
Merck Frosst Canada Ltd. |
02333872 |
|
A |
Sous examen |
3 |
| Lotemax - 5 mg/ml |
Bausch & Lomb Canada Inc. |
02321114 |
NAS |
S |
Sous examen |
3 |
| Lumigan - 0.1 mg/ml |
Allergan Inc. |
02324997 |
|
S |
Sous examen |
1 |
| MabCampath - 30 mg/fiole |
Genzyme Canada Inc. |
02290960 |
|
L |
Sous examen |
1 |
| Metvix - 168 mg/g |
Galderma Canada Inc. |
02323273 |
NAS |
L |
Conforme aux Lignes directrices |
3 |
| Mezavant - 1200 mg/comprimé |
Shire Canada Inc. |
02297558 |
PBA |
A |
Conforme aux Lignes directrices |
1 |
| Micardis Plus 80/25 - 105 mg/comprimé |
Boehringer Ingelheim Canada Ltd. |
02318709 |
|
C |
Conforme aux Lignes directrices |
1 |
| Miochol-E - 20 mg/fiole |
Novartis Pharma Canada Inc. |
02133326 |
PBA |
S |
Subject to Investigation |
1 |
| Multaq - 400 mg/comprimé |
sanofi-aventis Canada Inc. |
02330989 |
NAS |
C |
Sous examen |
3 |
| Niaspan FCT - 500 mg/comprimé |
Sepracor Pharmaceuticals Inc. |
02309254 |
|
C |
Sous examen |
1 |
| Niaspan FCT - 750 mg/comprimé |
Sepracor Pharmaceuticals Inc. |
02309262 |
|
C |
Sous examen |
1 |
| Niaspan FCT - 1000 mg/comprimé |
Sepracor Pharmaceuticals Inc. |
02309289 |
|
C |
Sous examen |
1 |
| Olmetec - 20 mg/comprimé |
Schering-Plough Canada Inc. |
02318660 |
NAS |
C |
Conforme aux Lignes directrices |
3 |
| Olmetec - 40 mg/comprimé |
Schering-Plough Canada Inc. |
02318679 |
NAS |
C |
Conforme aux Lignes directrices |
3 |
| Olmetec Plus 20/12.5 - 32.5 mg/comprimé |
Schering-Plough Canada Inc. |
02319616 |
NAS |
C |
Conforme aux Lignes directrices |
3 |
| Olmetec Plus 40/12.5 - 52.5 mg/comprimé |
Schering-Plough Canada Inc. |
02319624 |
NAS |
C |
Conforme aux Lignes directrices |
3 |
| Olmetec Plus 40/25 - 65 mg/comprimé |
Schering-Plough Canada Inc. |
02319632 |
NAS |
C |
Conforme aux Lignes directrices |
3 |
| Oxycontin - 15 mg/comprimé |
Purdue Pharma |
02323192 |
|
N |
Conforme aux Lignes directrices |
1 |
| Oxycontin - 30 mg/comprimé |
Purdue Pharma |
02323206 |
|
N |
Conforme aux Lignes directrices |
1 |
| Oxycontin - 60 mg/comprimé |
Purdue Pharma |
02323214 |
|
N |
Conforme aux Lignes directrices |
1 |
| Plavix - 300 mg/comprimé |
Bristol-Myers Squibb Canada Co. |
02330555 |
|
B |
Sous examen |
1 |
| Prezista - 400 mg/comprimé |
Janssen-Ortho Inc. |
02324016 |
|
J |
Conforme aux Lignes directrices |
1 |
| Prezista - 600 mg/comprimé |
Janssen-Ortho Inc. |
02324024 |
|
J |
Subject to Investigation |
1 |
| Pristiq - 50 mg/comprimé |
Wyeth Pharmaceuticals |
02321092 |
NAS |
N |
Conforme aux Lignes directrices |
3 |
| Pristiq - 100 mg/comprimé |
Wyeth Pharmaceuticals |
02321106 |
NAS |
N |
Conforme aux Lignes directrices |
3 |
| Rasilez HCT 150/12.5 - 162.5 mg/comprimé |
Novartis Pharma Canada Inc. |
02332728 |
|
C |
Sous examen |
3 |
| Rasilez HCT 150/25 - 175 mg/comprimé |
Novartis Pharma Canada Inc. |
02332736 |
|
C |
Sous examen |
3 |
| Rasilez HCT 300/12.5 - 312.5 mg/comprimé |
Novartis Pharma Canada Inc. |
02332744 |
|
C |
Sous examen |
3 |
| Rasilez HCT 300/25 - 325 mg/comprimé |
Novartis Pharma Canada Inc. |
02332752 |
|
C |
Sous examen |
3 |
| Seroquel XR - 150 mg/comprimé |
AstraZeneca Canada Inc. |
02321513 |
|
N |
Conforme aux Lignes directrices |
1 |
| Somatuline Autogel - 60 mg/syringe |
Tercica Inc. |
02283395 |
NAS/PBA |
H |
Conforme aux Lignes directrices |
3 |
| Somatuline Autogel - 90 mg/syringe |
Tercica Inc. |
02283409 |
NAS/PBA |
H |
Conforme aux Lignes directrices |
3 |
| Somatuline Autogel - 120 mg/syringe |
Tercica Inc. |
02283417 |
PBA |
H |
Conforme aux Lignes directrices |
3 |
| Sprycel - 20 mg/comprimé |
Bristol-Myers Squibb Canada Co. |
02293129 |
NAS/PBA |
L |
Conforme aux Lignes directrices |
2 |
| Sprycel - 50 mg/comprimé |
Bristol-Myers Squibb Canada Co. |
02293137 |
NAS/PBA |
L |
Conforme aux Lignes directrices |
2 |
| Sprycel - 70 mg/comprimé |
Bristol-Myers Squibb Canada Co. |
02293145 |
NAS/PBA |
L |
Conforme aux Lignes directrices |
2 |
| Sprycel - 100 mg/comprimé |
Bristol-Myers Squibb Canada Co. |
02320193 |
PBA |
L |
Conforme aux Lignes directrices |
1 |
| Stelara - 45 mg/fiole |
Janssen-Ortho Inc. |
02320673 |
NAS/PBA |
L |
Conforme aux Lignes directrices |
3 |
| Synflorix |
GlaxoSmithKline Inc. |
02320541 |
NAS |
J |
Conforme aux Lignes directrices |
3 |
| Tamiflu - 30 mg/gélule |
Hoffmann-LaRoche Limited |
02304848 |
|
J |
Conforme aux Lignes directrices |
1 |
| Tamiflu - 45 mg/gélule |
Hoffmann-LaRoche Limited |
02304856 |
|
J |
Conforme aux Lignes directrices |
1 |
| Tasigna - 200 mg/caplet |
Novartis Pharma Canada Inc. |
02315874 |
NAS/PBA |
L |
Subject to Investigation |
3 |
| Temodal - 140 mg/gélule |
Schering-Plough Canada Inc. |
02312794 |
|
L |
Conforme aux Lignes directrices |
1 |
| Temodal - 180 mg/gélule |
Schering-Plough Canada Inc. |
02312816 |
|
L |
Conforme aux Lignes directrices |
1 |
| Tykerb - 250 mg/comprimé |
GlaxoSmithKline Inc. |
02326442 |
NAS |
L |
Sous examen |
3 |
| Xamiol - 0.55 mg/g |
LEO Pharma Inc. |
02319012 |
|
D |
Conforme aux Lignes directrices |
1 |
| Xeomin - 100 unit/fiole |
Merz Pharma Canada Ltd. |
02324032 |
NAS |
M |
Sous examen |
3 |
| Xyntha - 250 unit/fiole |
Wyeth Pharmaceuticals |
02309483 |
|
B |
Conforme aux Lignes directrices |
1 |
| Xyntha - 500 unit/fiole |
Wyeth Pharmaceuticals |
02309491 |
|
B |
Conforme aux Lignes directrices |
1 |
| Xyntha - 1000 unit/fiole |
Wyeth Pharmaceuticals |
02309505 |
|
B |
Conforme aux Lignes directrices |
1 |
| Xyntha - 2000 unit/fiole |
Wyeth Pharmaceuticals |
02309513 |
|
B |
Conforme aux Lignes directrices |
1 |
| Yaz 28 3/0.02 |
Bayer Inc. |
02321157 |
|
G |
Conforme aux Lignes directrices |
1 |
| Zeftara - 500 mg/fiole |
Janssen-Ortho Inc. |
02313103 |
NAS/PBA |
J |
Conforme aux Lignes directrices |
3 |
| Zolinza - 100 mg/gélule |
Merck Frosst Canada Ltd. |
02327619 |
NAS |
L |
Sous examen |
3 |
| Zostavax |
Merck Frosst Canada Ltd. |
02315939 |
|
J |
Sous examen |
1 |
1 NAS : Nouvelle substance active
2 PBA : Premier brevet attribué
3 ATC : Classification anatomique thérapeutique chimique
Source : CEPMB
ANNEXE 3
REVENUS EXCÉDENTAIRES REMBOURSÉS PAR DES ENGAGEMENTS DE CONFORMITÉ VOLONTAIRE ET DES ORDONNANCES DU CONSEIL, 2006-2010
Depuis 1993, le Conseil a approuvé 66 engagements de conformité volontaire et entamé 24 audiences. Ces mesures ont donné lieu à des réductions de prix et au remboursement des recettes excessives au moyen de paiements au gouvernement du Canada et (ou) aux clients, dont les hôpitaux et les cliniques médicales.
La valeur cumulative des remboursements des recettes excessives au moyen de paiements au gouvernement dépassait plus de 37 millions de dollars en 2009. En date de la rédaction du présent rapport, la valeur des recettes excessives remboursées en 2010 était environ de six millions de dollars.
| |
2006 |
2007 |
2008 |
2009 |
2010
(en date de 31 mai) |
| Suite à une enquête |
| Engagements de conformité volontaire |
4 |
3 |
4 |
7 |
6 |
| ($) |
198 482 $ |
877 866 $ |
4,568 083 $ |
13,700 190 $ |
1 863 802 $ |
| Suite à une audience |
| Engagements de conformité volontaire |
|
3 |
|
3 |
|
| ($) |
669 515 $1 |
5 194 599 $ |
|
23 530 627 $ |
786 882 $1 |
| Ordonnances |
|
1 |
1 |
|
2 |
| ($) |
|
3 736 398 $ |
5 622 864 $ |
|
3 057 809 $ |
| Total |
867 997 $ |
9 808 863 $ |
10 190 947 $ |
37 230 817 $ |
5 708 493 $ |
1 Engagement de conformité volontaire approuvé l’année précedente.
ANNEXE 4
RECHERCHE-DÉVELOPPEMENT
TABLEAU 23 Ratio des dépenses de R-D par rapport aux recettes tirées des ventes, selon le nombre de brevetés ayant soumis des rapports et la valeur des recettes tirées des ventes
| Ratio : dépenses de R-D par rapport aux recettes tirées des ventes |
2009
Nbre de brevetés ayant soumis un rapport |
2009
Recettes tirées des ventes
millions $ % |
2009
Recettes tirées des ventes
des ventes |
2008
Nbre de brevetés ayant soumis un rapport |
2008
Recettes tirées des ventes
millions $ |
2008
Recettes tirées des ventes
% des ventes |
| 0% |
23 |
561,9 |
3,3 |
25 |
737,7 |
4,5 |
| ≤ 10% |
40 |
12,081,7 |
70,9 |
37 |
10 803,3 |
66,2 |
| > 10% |
18 |
4 408,3 |
25,9 |
20 |
4 775,7 |
29,3 |
| Total |
81 |
17 051,9 |
100,0* |
82 |
16 316,7 |
100,0* |
* Le total de la colonne peut ne pas totaliser exactement 100,0 du fait que certains chiffres ont été arrondis.
Source : CEPMB
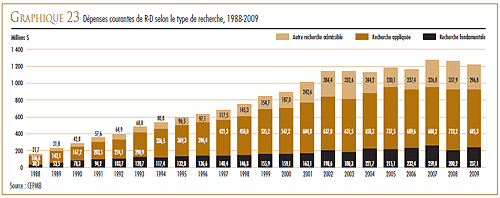
TABLEAU 24 Ratios des dépenses de R-D par rapport aux recettes tirées des ventes selon les brevetés qui soumettent leur rapport1, 2009 et 2008
| Breveté |
Ratio des dépenses de R-D par rapport aux recettes tirées des ventes (%)
2009 |
Ratio des dépenses de R-D par rapport aux recettes tirées des ventes (%)
2008 |
| Abbott Ltée, Les Laboratoires2,5 |
2,8 |
4,9 |
| Abraxis BioSciences Canada Inc.5 |
24,6 |
17,6 |
| Actelion Pharmaceutiques Canada Inc.2 |
9,3 |
7,8 |
| Alcon Canada Inc. |
0,3 |
0,3 |
| Allergan Inc. |
9,5 |
6,6 |
| Amersham Health Inc. (GE Healthcare Inc.) |
0,0 |
0,0 |
| Amgen Canada Inc.2,5 |
7,1 |
6,1 |
| Astellas Pharma Canada Inc.2,9,5 |
12,7 |
10,4 |
| AstraZeneca Canada Inc.2,5 |
6,1 |
6,7 |
| Axcan Pharma Inc.2 |
40,8 |
27,7 |
| Baxter Corporation5 |
0,1 |
0,2 |
| Bayer Inc., Healthcare Division2 |
3,3 |
3,2 |
| Biogen Idec Canada Inc.2,5 |
6,6 |
1,6 |
| Biovail Pharmaceuticals Canada, Division of Biovail Corporation5 |
4,6 |
23,5 |
| Biovitrum AB6 |
0,0 |
- |
| Boehringer Ingelheim (Canada) Ltée2 |
15,9 |
22,0 |
| Bracco Diagnostics Canada Inc. |
0,0 |
0,0 |
| Bristol-Myers Squibb Pharmaceutical Group2,5 |
10,1 |
13,3 |
| Celgene Canada5 |
2,8 |
- |
| Duchesnay Inc. |
3,4 |
12,3 |
| Eli Lilly Canada Inc. (includes Provel Animal Health Division)2,5 |
10,2 |
11,4 |
| EMD Serono Canada Inc.2,5 |
15,7 |
2,9 |
| Enzon Pharmaceuticals Inc. |
0,0 |
0,0 |
| Ferring Inc. |
4,8 |
2,9 |
| Fournier Pharma Inc.2,4 |
0,0 |
0,0 |
| Fresenius Kabi Canada |
0,7 |
0,7 |
| Fresenius Medical Care Canada |
0,0 |
0,0 |
| Galderma Canada Inc. |
0,4 |
1,1 |
| Genzyme Canada Inc.5 |
0,6 |
1,3 |
| Gilead Sciences Inc.5 |
32,6 |
45,8 |
| GlaxoSmithKline Inc.2,5 |
13,3 |
11,3 |
| Graceway Pharmaceuticals |
0,0 |
0,0 |
| Hoffmann-La Roche Canada Ltée2,5 |
5,2 |
3,8 |
| Hospira Healthcare Corp. |
0,0 |
0,0 |
| INO Therapeutics |
6,9 |
2,1 |
| Iroko International LP |
0,0 |
0,0 |
| Janssen-Ortho Inc.2,5 |
7,0 |
8,7 |
| Johnson & Johnson Merck, Consumer Pharmaceuticals of Canada |
0,0 |
0,0 |
| Lantheus MI Canada Inc. |
0,0 |
0,0 |
| LEO Pharma Inc.2 |
2,5 |
3,7 |
| Les Laboratories Inc.7 |
0,0 |
0,0 |
| Lundbeck Canada Inc.2 |
3,2 |
3,9 |
| Lundbeck Inc. (Ovation Pharmaceuticals Inc.) |
0,0 |
0,0 |
| McNeil Consumer Healthcare Canada |
1,9 |
2,9 |
| Merck Frosst Canada Ltd.2,5 |
12,1 |
14,8 |
| Merck Frosst ¨CSchering Pharma2 |
0,3 |
0,7 |
| Merz Pharma Canada Ltd.6 |
109,7 |
- |
| Novartis Consumer Health Canada Inc. |
0,0 |
0,0 |
| Novartis Pharmaceuticals Canada Inc.2,5 |
18,1 |
16,7 |
| Novo Nordisk Canada Inc.5 |
1,5 |
3,1 |
| Nycomed Canada Inc.2,3,5 |
0,6 |
0,7 |
| Ortho Dermatological, Division of Johnson & Johnson Inc. |
0,0 |
0,0 |
| Otsuka America Pharmaceuticals |
0,0 |
0,0 |
| Paladin Laboratories Inc.2 |
0,2 |
0,2 |
| Pfizer Canada Inc.2,5 |
4,1 |
4,9 |
| Pharmascience Inc. |
9,9 |
8,5 |
| Procter & Gamble Pharmaceuticals Canada, Inc.2,5 |
0,6 |
0,6 |
| Pharmaceutical Partners of Canada Inc. |
0,0 |
0,0 |
| Purdue Pharma2 |
1,9 |
1,7 |
| Rare Disease Therapeutics Inc. |
0,0 |
0,0 |
| sanofi pasteur Ltée2,5,10 |
52,7 |
53,9 |
| sanofi-aventis Pharma Inc.2,11 |
9,4 |
14,2 |
| Santhera Pharmaceuticals Canada Inc.5 |
7,8 |
111,9 |
| Schering-Plough Canada Inc.2,5 |
3,2 |
3,5 |
| Sepracor Pharmaceuticals Canada Inc. (Oryx Pharmaceuticals Inc,) |
0,0 |
0,0 |
| Servier Canada Inc.2 |
8,7 |
10,9 |
| Shire Canada Inc.2,5 |
0,0 |
0,0 |
| Shire Human Genetic Therapies5 |
2,1 |
3,8 |
| Solvay Pharma Inc.2,5 |
6,6 |
14,6 |
| Sopherion Therapeutics Canada Inc. |
118,1 |
0,0 |
| Stiefel Canada Inc. |
3,8 |
0,7 |
| Takeda Canada Inc.2,5,6 |
16,2 |
- |
| Talecris Biotherapeutics Ltd.5 |
0,5 |
0,9 |
| Tercica Inc.6 |
0,0 |
- |
| Teva Neuroscience Canada5 |
2,7 |
4,8 |
| Tyco Healthcare Group Canada Inc. |
0,0 |
0,0 |
| UCB Pharma Canada Inc.5 |
44,1 |
55,6 |
| Unither Biotech Inc. |
0,0 |
0,0 |
| Valeant Canada Ltd.8 |
2,9 |
1,8 |
| Wyeth Pharmaceuticals2,5 |
23,1 |
24,1 |
| YM Biosciences Inc.5 |
13611,6 |
12658,8 |
Notes :
1. Les recettes tirees des redevances sont comprises dans le ratio de chaque societe, mais pour eviter la double comptabilisation elles sont soustraites lorsqu’il y a lieu du total pour l’ensemble du secteur. Les subventions des gouvernements federal et provinciaux ne sont pas comptabilisees dans les depenses utilisees pour le calcul des ratios des depenses de R-D de chaque societe, mais elles le sont dans les statistiques pour l’ensemble des brevetes. La liste des brevetes ayant soumis un rapport sur les prix n’est pas identique a celle des brevetes ayant soumis un rapport sur leurs activites de R-D en raison des differences des modalites de rapport entre les brevetes et leurs societes affiliees ou les detenteurs d’une licence d’exploitation ainsi que du fait que les titulaires d’un brevet pour un medicament veterinaire sont tenus de presenter chaque annee un rapport sur leurs depenses de R-D, mais pas necessairement sur les prix qu’ils pratiquent et la valeur de leurs ventes.
2. Membre de Rx&D.
3. Auparavant appelé Altana Pharma Inc. (et avant BYK Canada Inc.).
4. Fusionné avec Solvay Pharma Inc.
5. Membre de BIOTECanada.
6. N’etait pas un brevete en 2009.
7. Le titulaire du brevet est Les Laboratories Inc., mais BLES Biochemicals est l’exploitant du brevet et le fabricant du medicament.
8. Auparavant appelé ICN Canada Ltd.
9. Auparavant appelé Fujisawa Canada Inc.
10. Auparavant appelé Aventis Pasteur Limited.
11. Auparavant appelé Aventis Pharma Inc.
12. Auparavant, Oryx Pharmaceuticals Inc.
Source : CEPMB
TABLEAU 25 Dépenses courantes de R-D selon la province et le milieu de recherche, 2009
Milieu de recherche
| Province |
|
Brevetés |
Autres sociétés |
Universités |
Hôpitaux |
Autres |
Total |
Rx&D |
Pourcentage des dépenses |
| Terre-Neuve |
$(000) |
532,43 |
1 783,35 |
359,85 |
866,34 |
972,39 |
4,514,37 |
4,216,05 |
0,370 |
| % |
11,79 |
39,50 |
7,97 |
19,19 |
21,54 |
100,00 |
0,386 |
| Île-du-Prince-Édouard |
$(000) |
18,95 |
173,92 |
8,50 |
74,61 |
20,97 |
296,96 |
296,96 |
0,024 |
| % |
6,38 |
58,56 |
2,86 |
25,12 |
7,06 |
100,00 |
0,027 |
| Nouvelle-Écosse |
(000) $ |
1,906,06 |
2,905,62 |
2,935,84 |
1,543,72 |
2,277,57 |
11,568,81 |
10,872,11 |
0,949 |
| % |
16,47 |
25,11 |
25,37 |
13,34 |
19,68 |
100,00 |
0,995 |
| Nouveau-Brunswick |
(000) $ |
403,00 |
1 378,96 |
58,61 |
913,30 |
417,13 |
3 171,00 |
3 151,64 |
0,260 |
| % |
12,70 |
43,48 |
1,84 |
28,80 |
13,15 |
100,00 |
0,288 |
| Québec |
(000) $ |
286 568,24 |
111 927,18 |
12 387,11 |
27 214,27 |
59 898,47 |
497 995,27 |
483 908,19 |
40,846 |
| % |
57,54 |
22,47 |
2,48 |
5,46 |
12,02 |
100,00 |
44,290 |
| Ontario |
(000) $ |
270 062,91 |
100 499,60 |
47 288,46 |
67 174,87 |
83 489,79 |
568 515,63 |
491 738,32 |
46,630 |
| % |
47,50 |
17,67 |
8,31 |
11,81 |
14,68 |
100,00 |
45,007 |
| Manitoba |
(000) $ |
2 829,21 |
1 589,09 |
655,51 |
1 899,34 |
1 155,54 |
8 128,69 |
7 216,81 |
0,667 |
| % |
34,80 |
19,54 |
8,06 |
23,36 |
14,21 |
100,00 |
0,661 |
| askatchewan |
(000) $ |
1 178,23 |
747,33 |
1 122,70 |
426,51 |
713,93 |
4 188,71 |
4 136,69 |
0,344 |
| % |
28,12 |
17,84 |
26,80 |
10,18 |
17,04 |
100,00 |
0,379 |
| Alberta |
(000) $ |
54 137,76 |
8 826,83 |
10 846,93 |
2 700,31 |
4 955,80 |
81 467,63 |
49 420,14 |
6,682 |
| % |
66,45 |
10,83 |
13,31 |
3,31 |
6,08 |
100,00 |
4,523 |
| Colombie-Britannique |
(000) $ |
11 121,19 |
12 797,33 |
2 400,58 |
7 050,27 |
5 944,68 |
39 314,04 |
37 587,34 |
3,225 |
| % |
28,28 |
32,55 |
6,10 |
17,93 |
15,12 |
100,00 |
3,440 |
| Yukon, T,-N-O., Nunavut |
(000) $ |
00,00 |
00,00 |
00,00 |
00,00 |
34,00 |
34,00 |
34,000 |
0,003 |
| % |
00,00 |
00,00 |
00,00 |
00,00 |
100,00 |
100,00 |
0,003 |
| Canada |
(000) $ |
628 757,99 |
242 629,21 |
78 064,10 |
109 863,54 |
159 880,27 |
1 219 195,11 |
1 092 578,27 |
100,00 |
Notes :
- Le pourcentage figurant sous chaque catégorie de R-D correspond au pourcentage de toutes les dépenses encourues dans cette catégorie dans la province.
- Les depenses presentees sous forme de pourcentage du total correspondent au pourcentage des depenses de R-D par rapport a l’ensemble des depenses de R-D faites au Canada.
- Le total des colonnes et des rangées ne correspond pas nécessairement, car certains chiffres ont été arrondis.
- Dépenses courantes plus dépenses en immobilisations (équipement + amortissement) = total des dépenses de R-D.
Source : CEPMB