Final Report - Recommendations on Implementation of the DIP Methodology
DIP Methodology Technical Working Group
March, 2011
Introduction
The Guidelines that came into effect on January 1, 2010, included the DIP Methodology to address the situation where benefits to customers are reduced or end. At the time of implementation of these Guidelines, the PMPRB noted that it would, on an ongoing basis, monitor and evaluate their application, and assess the need for further changes.
Since the review of prices of existing patented drug productsFootnote 1 is carried out based on full-year data, there have been no cases where the DIP Methodology was applied for 2010. The DIP Methodology has been discussed with some patentees in the context of ongoing existing investigations. Based on these discussions, the PMPRB has acquired some early insights into the application of the DIP Methodology.
The DIP Methodology Technical Working Group (DIP-WG) was established to identify challenges in applying the DIP Methodology under the Guidelines, and develop workable solutions to ensure that the Board's objective in adopting the DIP Methodology is met. This report, developed by the DIP-WG, explores the practical challenges faced by industry and Board Staff when invoking the DIP Methodology and provides options to the Board for its successful implementation.
Intent of the DIP Methodology
The Board did not wish to create disincentives to the offering of "benefits" to customers, and adopted the DIP Methodology as an alternative to the application of the CPI-Adjustment Methodology in certain specific circumstances. Schedule 10 of the Guidelines defines a benefit as "any reduction given as a promotion or in the form of rebates, discounts, refunds, free goods, free services, gifts or any other benefits of a like nature."Footnote 2
Provisions in the Guidelines for the DIP Methodology
The DIP Methodology states that:
"If a price increase in excess of that allowable under the CPI-Adjustment Methodology is claimed by the patentee as due to the reduction or termination of benefit(s) - and the patentee provides the necessary evidence of the benefit(s) - the drug product's National Non-Excessive Average Price and/or Market-Specific Non-Excessive Average Price(s) may increase beyond the level allowable under the CPI-Adjustment Methodology."
Although the form of evidence required to invoke the DIP Methodology depends on the specifics of each case, Schedule 10 of the Guidelines provides general direction for patentees stating that patentees should:
- Demonstrate that the recipient of the benefit was aware in advance that it was receiving a benefit not offered to all customers;
- Identify the type and value of benefit(s) and when/how it was offered;
- Provide evidence of the termination or reduction of a benefit(s);
- Identify whether the same customer is still receiving other benefits.
When a Market-Specific Average Transaction Price of a drug product increases by more than that allowable under the CPI-Adjustment Methodology and the patentee provides the required evidence, the price of the drug product may increase up to the highest Non-Excessive Average Price of another class of customer (province/territory) without being presumed to be excessive, as long as this price does not exceed the HIPC test.
The ability to rebound to the highest Non-Excessive Average Price of another market is contingent on evidence demonstrating that benefits are no longer offered in the market employing the DIP Methodology. In markets where some benefits are ongoing, the DIP Methodology limits the rebound in price to a price commensurate with the remaining benefit. Markets are defined as hospital, wholesaler and pharmacy markets within the class of customer markets and each province and territory within the provincial/territorial markets.
DIP Methodology Technical Working Group (DIP-WG)
The DIP-WG consisted of three representatives of the innovative pharmaceutical industry, two representatives of the biotechnology industry, one representative of the generic pharmaceutical industry, and four members of Board Staff, including the Chairperson of the group (see Annex A for a list of group members). Meetings were chaired by Michelle Boudreau, Executive Director of the PMPRB, and PMPRB Staff provided secretariat support. The DIP-WG met four times between January 20, 2011, and February 23, 2011.
The mandate of the DIP-WG was to develop advice and options for the successful implementation of the PMPRB's DIP Methodology for the Board's consideration. The DIP-WG was tasked with identifying any significant challenges in implementing the DIP Methodology and outlining options to address these challenges. However, it was acknowledged that all final decisions related to the DIP Methodology and the Guidelines rest with the Board.
Issues and Challenges Identified
Based on discussions between patentees and Board Staff in the context of existing investigations, the following challenges to the implementation of the DIP Methodology were identified.
Onerous Evidence Requirements
Current evidence requirements for successful implementation of the DIP Methodology are too onerous for patentees. Indeed, finding resources to meet evidence requirements is challenging as data may not always be retrievable due to technical issues, such as how data has been stored, or due to mergers and acquisitions.
There may not always be individual contracts for all purchasers within a class (e.g., group purchasing), making it difficult to demonstrate that the recipient of the benefit was aware in advance that it was receiving a benefit not offered to all customers. Numerous contracts may be awarded within a class of customer, leading to a great deal of complexity, paperwork, and resource requirements when dealing with evidence pertaining to classes of customers within ¡°Any Market¡±. This would often require retrieving data at the level of the individual purchaser or down to the individual transaction level.
Any Market
A further challenge regarding the application of the DIP Methodology is the review of prices of existing patented drug products in each of the markets. The Guidelines provide that where the National Average Transaction Price (N-ATP) exceeds the National Non-Excessive Average Price (N-NEAP) by an amount which triggers the investigation criteria, a review is undertaken for each class of customer and for each province/territory. Each class of customer and each province/territory have a Non-Excessive Average Price (NEAP); the price in each of these markets is also limited by the CPI-Adjustment Methodology and, except for the Wholesaler class of customer, the Highest International Price Comparison. Therefore, if a patentee invokes the DIP Methodology in the context of an investigation, the patentee would need to account for all sub-markets that appear excessive before the DIP could be applied and the investigation closed. The need to account for all sub-markets considerably increases the evidentiary requirements of patentees and the review of this information by Board Staff will significantly increase the time required to conduct investigations.
Related Issues
In a message to patentees issued in December 2010, the PMPRB indicated that the review of prices of existing patented drug products related to the review of prices in any market and the DIP Methodology would not be implemented at this time.
The DIP-WG identified two additional issues related to the application of the DIP Methodology:
(1) An increase in the Average Transaction Price (ATP) is not necessarily due to a price increase, but rather could be a result of business conditions that are beyond the control of patentees, such as volume fluctuations due to variable uptake of benefits, some markets opting into certain benefits, loss of contracts, etc. Thus, it is not accurate to label an ATP fluctuation as a price increase.
(2) Refunds or returns can also have an impact on the ATP calculation. The ATP may appear inflated as returns are included in terms of units and net revenues. Due to locations of warehouses, returns may be credited to a market in a different province/territory than the initial sales transaction. This incorrectly reflects the reported sales for each market and impacts the ATP at the national level. Where a patentee has a drug product for which returns are causing fluctuations in the ATP, the advice provided by Board Staff should be that patentees file returns on a separate line of data.
Guiding Principles for Developing a Solution
A set of guiding principles were developed to identify the criteria that would be used to evaluate proposed solutions for making the DIP Methodology more workable:
- Feasible: The DIP Methodology should be both technically feasible and manageable from both the PMPRB and patentee perspective.
- Transparency: A more standardized and streamlined method for reporting evidence is required.
- Predictability and consistency: The method of application of the DIP Methodology should be universal in that it should apply to all instances, regardless of the size of the company, the volume of products sold, or the type of product. It should also be one that the patentee can easily apply.
- Premise should not be based on price increase: The premise of the DIP Methodology should be based on a price adjustment or a price rebound, not a price increase.
- Adopt a high-level approach: A big-picture approach should be first taken into consideration in order to account for market realities facing patentees.
- Investigations should not be conducted for years where the PMPRB has already deemed the ATP compliant: If during a DIP Methodology discussion there is a review of previous year(s) data that were deemed compliant, it should be for information purposes only. Thus, in the context of applying the Board's Guidelines, the PMPRB should conduct an investigation only for the year that triggered the investigation criteria.
- Apply appropriate terminology: Terminology should not be too narrow in that it is too prescriptive, yet not too broad that guidance provided is too vague.
Recommendations
A number of options were discussed, including the status quo. It was agreed that the method in which the current DIP Methodology is applied is not workable, and does not address the Board's objective in implementing the DIP Methodology. The status quo does not reflect the guiding principles set out above.
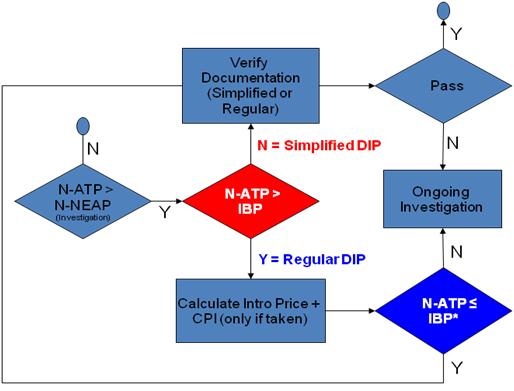
In order to simplify the task of reporting, the DIP-WG proposes that the DIP Methodology be broken down into two processes: Simplified DIP Methodology and Regular DIP Methodology, as illustrated in Figure 1.
Figure 1: Process Map for Simplified and Regular DIP Methodology
Simplified DIP Methodology
The Simplified DIP Methodology is a simplified approach for the DIP Methodology in situations where the National Average Transaction Price (N-ATP) of the patented drug product is less than or equal to the Introductory Benchmark Price (IBP) for that patented drug product.
Simplified DIP Methodology Where: N-ATP ¡Ü IBP
This is based on the principle that if the price is below a level that was deemed non-excessive by the PMPRB at introduction, less evidence should be required to account for a change in ATP resulting from the fluctuation in benefits.
Evidence required for invoking the Simplified DIP Methodology for a patented drug product should be a form that would include the following data:
- Product name
- DIN
- Period of review (should be the same period that is under investigation)
- Background information, including a description of the circumstances
- Brief description of the benefit, including information on when the benefit commenced and terminated, and the type and value of the benefit
- An attestation paragraph using standard attestation text, as per Form 2 (should be signed by the same individual that signed Form 2).
The above data should be sufficient to satisfy the four criteriaFootnote 3 set out in the Guidelines for invoking the DIP Methodology. If a patentee provides the above required data Board Staff should conclude that the requirements of the Simplified DIP Methodology have been met and that the ATP of the drug product in question is within the Guidelines, and the investigation should be closed.
Regular DIP Methodology
The Regular DIP Methodology is an expanded version of the Simplified DIP Methodology, which requires some additional evidence from patentees. The Regular DIP Methodology is used when the National Average Transaction Price (N-ATP) of a patented drug product is greater than the Introductory Benchmark Price, but not more than the Introductory Benchmark Price adjusted for the actual price increases taken by a patentee in terms of list price where these price increases are within the Guidelines (referred to as IBP* in Figure 1).
Regular DIP Methodology Where: IBP < N-ATP ¡Ü IBP*
The DIP Methodology would not automatically apply in cases where the National Average Transaction Price is greater than the IBP*. Further investigation would be required.
A greater level of documentation would be required when invoking the Regular DIP Methodology. The following are the DIP-WG's recommended forms of evidence to be required:
- A completed form for invoking the Simplified DIP Methodology
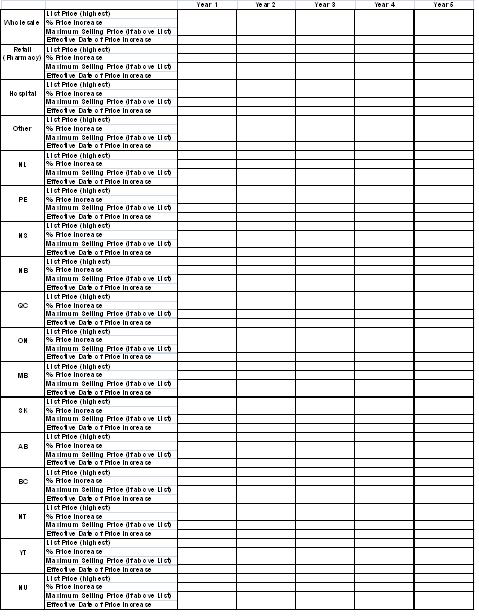
- A Price Increase Chart, as per Annex B. (Board Staff will verify the information in the chart to ensure that the price is one that has actually been paid, with Blocks 4 and 5 data and any other relevant sources.)
- Data should be provided for all of the years under consideration. At a minimum, the number of years reported should reflect the duration of the contract or benefit.
- A sample of invoices may be requested by Board Staff, especially when Block 4 data does not coincide with pricing information provided in the chart.
- Further evidence and supporting data may be requested by Board Staff, and will be determined on a case-by-case basis.
If it is concluded that a patentee successfully meets the requirements of the Regular DIP Methodology, Board Staff should conclude that the ATP of the drug product in question is within the Guidelines, and the investigation should be closed.
The possible impacts of returns on the application of the DIP Methodology were also discussed. Where a patentee has a drug product for which returns are causing fluctuations in the ATP, the advice provided by Board Staff is that patentees should file returns on a separate line of data.
Although the mandate of the DIP-WG was to make recommendations regarding the DIP Methodology, the members were of the view that the current provisions in the Guidelines regarding the price review at the level of "Any Market" and the current CPI-Adjustment Methodology are not conducive to the successful implementation of the proposed solution. Hence the DIP-WG suggests that these be identified by the Board as areas of further work. The underlying assumption for the Simplified and the Regular DIP Methodology is that there will be no price review at the level of "Any Market". With regard to the potential unintended consequences of the CPI-Adjustment Methodology, the DIP-WG proposes an interim solution based on a current standard of practice used by Board Staff when dealing with a sales-mix shift.
Conclusion
Regardless of how the Board chooses to modify the DIP Methodology, the goal should in essence be to demonstrate reasonably that there was a valid change in benefits. The proposed recommendation within this report meets this goal, as well as satisfies all of the Guiding Principles identified by the DIP-WG.
In addition to the recommendations made for the DIP Methodology, there were also a number of other issues identified in this report that were beyond the scope of the mandate of the DIP-WG. The Board is encouraged to consider and address these additional issues as part of its ongoing efforts to monitor and evaluate the implementation of the Guidelines.
Annex A
Membership for the DIP Methodology Technical Working Group
(Sorted Alphabetically by Last Name)
(Sorted Alphabetically by Last Name)
| Member |
Title |
|
Matthew Bondy
|
Acting Director - Policy and Economic Analysis
Patented Medicine Prices Review Board
|
|
Michelle Boudreau
Chairperson
|
Executive Director
Patented Medicine Prices Review Board
|
|
Leonor Ferreira
Generic Representative
|
Director - Government Relations
Sandoz Canada Inc.
|
|
Peter Giakoumatos
Brand Representative
|
Manager - Strategic Pricing and Contracts
Merck
|
|
Claudia Neuber
Brand Representative
|
Director, Pricing and Contracting
Astra Zeneca
|
|
Salma Pardhan
Secretariat
|
Senior Policy Analyst
Patented Medicine Prices Review Board
|
|
Steve Popp
Brand Representative
|
Director, Pricing and Account Management
GlaxoSmithKline Inc.
|
|
Laurene Redding
Biotech Representative
|
Director - Government and Economic Affairs
Takeda Canada Inc.
|
|
Kimberly Robinson
Alternative Brand Representative
|
Director - Strategic Pricing
Janssen Inc.
|
|
Janet Thompson Mar
Biotech Representative
|
Director - Contract Operations
Talecris Biotherapeutics
|
|
Ginette Tognet
|
Director - Regulatory Affairs and Outreach
Patented Medicine Prices Review Board
|
Annex B
Price Increase Chart